
分析 (1)电解质是指溶于水溶液中或在熔融状态下就能够导电的化合物;一种(或多种)物质分散在另一种(或多种)物质中所形成的体系称为分散体系,属于混合物;
(2)假设氧原子物质的量为3mol,计算SO2和SO3的物质的量,再根据m=nM计算二者质量之比;
(3)依据2Fe3++2I-═2Fe2++I2,2Fe2++Br2═2Fe3++2Br-,Cl2+2Br-═2Cl-+Br2.可知碘离子还原性强于二价铁离子,二价铁离子还原性强于溴离子,氯气通入含有三种离子的溶液中,发生氧化反应顺序为:碘离子、二价铁离子、溴离子,据此解答.
解答 解:(1):①H2O是化合物,能电离产生自由移动离子而导电属于电解质;
②Fe(OH)3胶体是混合物,属于分散系中的胶体;
③Mg是单质,不是电解质,也不是分散系;
④蔗糖是化合物,水溶液和熔融状态都不导电,属于非电解质;
⑤盐酸溶液是混合物,属于分散系中的溶液;
⑥Ca(OH)2水溶液中或在熔融状态下就能够导电是化合物,属于电解质;
所以属于电解质的是:①⑥;属于分散系的是:②⑤;
故答案为:①⑥;②⑤;
(2)假设氧原子物质的量为3mol,SO2为1.5mol,SO3的物质的量为1mol,二者物质的量之比为1.5mol:1mol=3:2,二者质量之比为1.5mol×64g/mol:1mol×80g/mol=6:5,
故答案为:6:5; 3:2;
(3)依据2Fe3++2I-═2Fe2++I2,2Fe2++Br2═2Fe3++2Br-,Cl2+2Br-═2Cl-+Br2.可知碘离子还原性强于二价铁离子,二价铁离子还原性强于溴离子,氯气通入含有三种离子的溶液中,发生氧化反应顺序为:碘离子、二价铁离子、溴离子,
向含有1mol FeI2和1mol FeBr2的溶液中,含有碘离子2mol,二价铁离子2mol,溴离子2mol,通入2mol Cl2,则只氧化碘离子、二价铁离子;
通入3mol氯气时,碘离子、溴离子、二价铁离子都被氧化,反应后溶液为氯化铁溶液,只含有三价铁离子、氯离子;
故答案为:I-、Fe2+; Fe3+、Cl-.
点评 本题考查了电解质、分散系的判断,有关阿伏伽德罗常数的计算,熟悉电解质、分散系的概念是解题关键,氧化还原反应中,注意明确离子还原性强弱顺序,明确氧化还原反应的先后规律,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 逆反应速率增大,正反应速率减小 | B. | 逆反应速率减小,正反应速率增大 | ||
| C. | 逆反应速率先增大后减小 | D. | 正反应速率先减小后增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.4g镁变为镁离子失去的电子数为0.1NA | |
| B. | 电解精炼铜时,若阴极得到电子数为2NA个,则阳极质量减少64g | |
| C. | 标准状况下,2.24L四氯化碳含有分子的数目为0.1NA | |
| D. | 常温常压下,Na2O2与足量H2O反应,当生成0.2molO2时,转移电子的数目为0.4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 平均相对分子质量 | B. | 密度 | ||
| C. | 容器内的压强 | D. | 物质的量 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
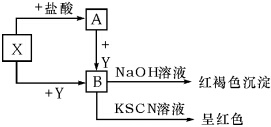 常见金属X,有下列关系图,根据图示回答:
常见金属X,有下列关系图,根据图示回答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 无色酚酞溶液 | B. | pH试纸 | C. | Na2CO3溶液 | D. | 紫色石蕊溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3S2-+2NO3-+8H+→2NO↑+3S↓+4H2O | |
| B. | S2-+2NO3-+4H+→2NO2↑+S↓+2H2O | |
| C. | Fe3++3NO3-+5H2S+2H+→3NO↑+5S↓+Fe2++6H2O | |
| D. | Fe3++5NO3-+8H2S+4H+→5NO↑+8S↓+Fe2++10H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com