
(15分)(1)氯化铝水溶液呈 性,原因是(用离子方程式表示):
。把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是 ,Al2(SO4)3溶液蒸干最后得到的固体产物是 ;
(2)NaHCO3的水溶液呈 (填“酸”、“中”或“碱”)性,实验室保存NaHCO3溶液的试剂瓶应用 塞,原因是 (写出有关的离子方程式);
(3)普通泡沫灭火器是利用NaHCO3溶液跟Al2(SO4)3溶液混合,产生大量的气体和沉淀,气体将混合物压出灭火器,相关反应的离子方程式是 。
(4)现有浓度均为0.1 mol/L的下列溶液:①硫酸、②醋酸、③氢氧化钠、④氯化铵、⑤醋酸铵、⑥硫酸铵、⑦硫酸氢铵、⑧氨水。
①、②、③、④四种溶液中由水电离出的H+浓度由大到小的顺序是(填序号) ;④、⑤、⑥、⑦、⑧五种溶液中NH4+浓度由大到小的顺序是(填序号) 。
(1)酸 Al3+ + 3H2O Al(OH)3+ 3H+ Al2O3 Al2(SO4)3
Al(OH)3+ 3H+ Al2O3 Al2(SO4)3
(2)碱 橡皮 HCO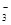 + H2O
+ H2O H2CO3 + OH— 2OH— +SiO2 = SiO2
H2CO3 + OH— 2OH— +SiO2 = SiO2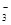 + H2O
+ H2O
(3)3HCO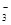 + Al3+= Al(OH)3↓+ 3CO2↑
+ Al3+= Al(OH)3↓+ 3CO2↑
(4)④、②、③、①;⑥、⑦、④、⑤、⑧
解析试题分析:(1)氯化铝是强酸弱碱盐,水解显酸性,方程式为Al3+ + 3H2O Al(OH)3+ 3H+;由于水解是吸热的,所以升高温度,促进水解,且氯化氢极易挥发,所以最终得到的是氢氧化铝,灼烧得到氧化铝。由于硫酸是难挥发性的,所以将硫酸铝溶液蒸干,得到的是Al2(SO4)3。
Al(OH)3+ 3H+;由于水解是吸热的,所以升高温度,促进水解,且氯化氢极易挥发,所以最终得到的是氢氧化铝,灼烧得到氧化铝。由于硫酸是难挥发性的,所以将硫酸铝溶液蒸干,得到的是Al2(SO4)3。
(2)碳酸氢钠由于水解程度大于电离程度,所以溶液显碱性。由于碱能和玻璃中的二氧化硅反应生成黏性强的硅酸钠,而使瓶塞和瓶口打不开,所以应该用橡皮塞。方程式分别为
HCO3-+H2O H2CO3+OH-、2OH-+SiO2=SiO32-+H2O。
H2CO3+OH-、2OH-+SiO2=SiO32-+H2O。
(3)碳酸氢钠和硫酸铝水解相互促进,生成氢氧化铝和CO2,方程式为3HCO3-+Al3+=Al(OH)3↓+3CO2↑。
(4)酸或碱的溶液中氢离子浓度或OH-浓度越大,对水的抑制程度越大。硫酸是二元强酸,氢氧化钠是一元强碱,醋酸是弱酸,氯化铵水解促进水的电离,所以①、②、③、④四种溶液中由水电离出的H+浓度由大到小的顺序是④、②、③、①;醋酸根水解显碱性,促进NH4+水解。磷酸氢铵难电离出氢离子,抑制NH4+水解。氨水是弱碱,所以④、⑤、⑥、⑦、⑧五种溶液中NH4+浓度由大到小的顺序是⑥、⑦、④、⑤、⑧。
考点;考查盐类水解的应用
点评:盐电离出来的离子结合水电离出来的 H+或 OH-生成弱电解质的过程。盐类水解的应用主要有:①判断盐溶液的酸碱性和比较盐溶液酸碱性的强弱时,通常需考虑盐的水解。②比较盐溶液中各离子浓度的相对大小时,当盐中含有易水解的离子,需考虑盐的水解。③判断溶液中离子能否大量共存。当有弱碱阳离子和弱酸阴离子之间能发生强烈双水解,则不能在溶液中大量共存。④配制易水解的盐溶液时,需考虑抑制盐的水解。⑤选择制备盐的途径时,需考虑盐的水解。⑥离子除杂、化肥的使用需考虑盐类的水解。⑦溶液中离子浓度大小比较时需要考虑盐类水解。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
 Al(OH)3+3H+
Al(OH)3+3H+ Al(OH)3+3H+
Al(OH)3+3H+查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
+ 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 Al(OH)3+3H+
Al(OH)3+3H+ Al(OH)3+3H+
Al(OH)3+3H+ HS-+OH-,HS-+H2O
HS-+OH-,HS-+H2O  H2S+OH-
H2S+OH- HS-+OH-,HS-+H2O
HS-+OH-,HS-+H2O  H2S+OH-
H2S+OH-| 1 | 2 |
查看答案和解析>>
科目:高中化学 来源:2014届辽宁盘锦第二高中高二第二次阶段考试化学试卷(解析版) 题型:填空题
(15分)(1)氯化铝水溶液呈 性,原因是(用离子方程式表示):
。把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是 ,Al2(SO4)3溶液蒸干最后得到的固体产物是 ;
(2)NaHCO3的水溶液呈 (填“酸”、“中”或“碱”)性,实验室保存NaHCO3溶液的试剂瓶应用 塞,原因是 (写出有关的离子方程式);
(3)普通泡沫灭火器是利用NaHCO3溶液跟Al2(SO4)3溶液混合,产生大量的气体和沉淀,气体将混合物压出灭火器,相关反应的离子方程式是 。
(4)现有浓度均为0.1 mol/L的下列溶液:①硫酸、②醋酸、③氢氧化钠、④氯化铵、⑤醋酸铵、⑥硫酸铵、⑦硫酸氢铵、⑧氨水。
①、②、③、④四种溶液中由水电离出的H+浓度由大到小的顺序是(填序号) ;④、⑤、⑥、⑦、⑧五种溶液中NH4+浓度由大到小的顺序是(填序号) 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com