
分析 (1)①依据0.1mol/L H3PO3溶液的pH=1.7,H3PO3可知不能完全电离;由H3PO3与NaOH反应只生成Na2HPO3和NaH2PO3两种盐,则说明亚磷酸是二元酸;由H3PO3和碘水反应,碘水棕黄色褪去,再加AgNO3有黄色沉淀生成,说明该反应中亚磷酸失电子作还原剂,所以亚磷酸有还原性;
②H3PO3与少量NaOH溶液反应生成NaH2PO2和H2O;
③H3PO3为二元酸,据此判断Na2HPO3类别;
(2)依据沉淀转化原则:难溶的可以转化为更难溶的,结合沉淀溶解平衡移动影响因素解答;硫酸铜与碘化钾反应生成碘化亚铜、碘单质和硫酸钾;
(3)丁达尔效应是胶体特有性质.
解答 解:(1)①由0.1mol/L H3PO3溶液的pH=1.7,说明亚磷酸部分电离,则亚磷酸是弱酸;由H3PO3与NaOH反应只生成Na2HPO3和NaH2PO3两种盐,则说明亚磷酸是二元酸;由H3PO3和碘水反应,碘水棕黄色褪去,再加AgNO3有黄色沉淀生成,说明该反应中亚磷酸失电子作还原剂,所以亚磷酸有还原性,所以亚磷酸为二元还原性弱酸;
故答案为:B;
②H3PO3与少量NaOH溶液反应生成NaH2PO2和H2O,离子方程式:H3PO3+OH-═H2PO3-+H2O;
故答案为:H3PO3+OH-═H2PO3-+H2O;
③H3PO3为二元酸,所以Na2HPO3为正盐;
故答案为:正盐;
(2)碘化亚铜可作催化剂,饲料添加剂等,是难溶于水的固体.铜可以与氢碘酸发生置换反应得到氢气,是生成难溶于水的碘化亚铜促进反应正向进行,CuSO4溶液也能使淀粉-KI试纸变蓝,是铜离子氧化I-离子为I2,本身被还原生成碘化亚铜,结合原子守恒、电子守恒和电荷守恒配平书写离子方程式为:2Cu2++4I-=2CuI↓+I2;故答案为:由于CuI难溶于水,使得生成物中的离子浓度减小有利于反应向右进行,2Cu2++4I-=2CuI↓+I2;
(3)检验纳米Cu2O,在检验溶液是否具有丁达尔效应,
故答案为:丁达尔效应.
点评 本题为综合题,涉及弱电解质的电离、离子方程式书写、沉淀溶解平衡影响因素、胶体的性质,熟悉相关物质的性质,明确弱电解质电离特点、沉淀溶解平衡移动影响因素的解题关键,题目难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸钠的水解:CO32-+2H2O?H2CO3+2OH- | |
| B. | 钠和CuSO4溶液反应:2Na+Cu2+═Cu+2Na+ | |
| C. | 用食醋溶解水垢:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| D. | 向NaAlO2溶液中通入过量CO2制Al(OH)3:CO2+AlO2-+2H2O═Al(OH)3↓+HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用醋酸除去水垢:CaCO3+2H+=Ca2++H2O+CO2↑ | |
| B. | 利用腐蚀法制作印刷线路板:Fe3++Cu=Fe2++Cu2+ | |
| C. | 溴乙烷中滴入AgNO3溶液检验其中的溴元素:Br-+Ag+=AgBr↓ | |
| D. | 用液溴和苯在催化剂作用下制溴苯: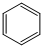 +Br2$\stackrel{催化剂}{→}$ +Br2$\stackrel{催化剂}{→}$ +HBr +HBr |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶质的质量分数为w=$\frac{a}{Vρ-a}$×100% | |
| B. | 溶质的物质的量浓度c=$\frac{1000a}{17V}$ mol•L-1 | |
| C. | 上述溶液中再加入相同质量的水后,所得溶液的物质的量浓度变为原来一半 | |
| D. | 上述溶液中再加入V mL水后,所得溶液溶质的质量分数大于0.5w |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com