
分析 Ⅰ.(1)依据热化学方程式和盖斯定律计算得到所需热化学方程式;
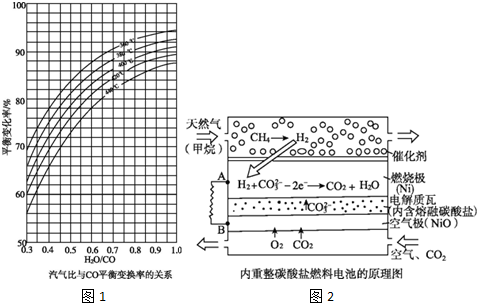
(2)依据图象中曲线的变化分析存在的变化规律,采取定一议二的方法分析归纳;
(3)将化学平衡常数中的浓度c换成压强P就可以得到KP;反应是放热反应,升高温度平衡逆向进行;
Ⅱ.该燃料电池中,通入甲烷的一极为原电池的负极,发生氧化反应,电极反应式为CH4-8e-+4CO32-=5CO2+2H2O,通入空气和CO2的混合气体一极为原电池的正极,发生还原反应,电极反应式为O2+4e-+2CO2=2CO32-;
(1)原电池原理分析,电子流向是从负极流向正极,装置中A为负极,B为正极,所以外电路电子流向为A流向B;
(2)空气极是氧气得到电子,生成碳酸根离子的反应;
(3)依据电子守恒结合电极反应计算得到;
解答 解:Ⅰ.(1)①CH4(g)+H2O(g)?CO(g)+3H2(g)△H=+206.2kJ/mol
②CH4(g)+2H2O(g)?CO2(g)+4H2(g)△H=+165.0kJ/mol
依据盖斯定律计算②-①得到:CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41.2 kJ/mol;
故答案为:CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41.2 kJ/mol;
(2)①依据图象曲线变化分析可知,温度一定,汽气比越大CO平衡变化率越大;
故答案为:汽气比越大CO平衡变化率越大;
②汽气比相同时,图象分析可知,CO平衡变换率与温度的关系是,温度越高,CO平衡变化率越小;
故答案为:温度越高CO平衡变化率越小;
(3)CH4(g)+H2O(g)?CO(g)+3H2(g),对于气相反应,用某组分(B)的平衡压强(pB)代替物质的量浓度也可以表示平衡常数(记作Kp),反应的平衡常数=$\frac{P(C{O}_{2})•P({H}_{2})}{P(CO)•P({H}_{2}O)}$;反应是放热反应,升高温度平衡向吸热反应方向移动,平衡逆向进行,平衡常数增大;
故答案为:$\frac{P(C{O}_{2})•P({H}_{2})}{P(CO)•P({H}_{2}O)}$; 增大;
Ⅱ.(1)原电池原理分析,电子流向是从负极流向正极,装置中A为负极,B为正极,所以外电路电子流向为A流向B;
故答案为:A;B;
(2)原电池正极上的电极反应式为O2+4e-+2CO2=2CO32-,
故答案为:O2+4e-+2CO2=2CO32-;
(3)电解精炼铜,阴极上铜离子得到电子生成铜,电极反应Cu2++2e-=Cu,当电路有0.6mol e-转移反应生成铜0.3mol,质量=0.3mol×64g/mol=19.2 g;
故答案为:19.2.
点评 本题考查了热化学方程式书写,图象分析判断的方法应用,原电池原理的分析判断和电极反应的分析判断,题目难度中等,掌握基础是解题的关键,试题培养了学生的分析能力及灵活应用能力.


 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:选择题
| 研究目的 | 温度(T) 对反应的影响 | 压强(p)对平衡常数的影响 | 压强(p)对反应的影响(p2>p1) | 温度(T)对反应的影响(T1>T2) |
| 图示 |  |  |  |  |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
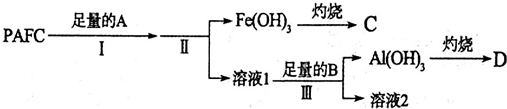
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
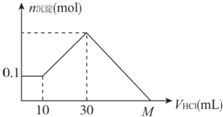 某一固体物质可能由NaOH、AlCl3、MgCl2中的几种组成,将其一定量溶于水,有沉淀产生,在所得悬浊液中逐滴加入5 mol/L的盐酸,图表示盐酸加入量与沉淀量的变化关系,图中M点表示已加入的盐酸体积,则M点的体积是( )
某一固体物质可能由NaOH、AlCl3、MgCl2中的几种组成,将其一定量溶于水,有沉淀产生,在所得悬浊液中逐滴加入5 mol/L的盐酸,图表示盐酸加入量与沉淀量的变化关系,图中M点表示已加入的盐酸体积,则M点的体积是( )| A. | 70 mL | B. | 90 mL | C. | 100 mL | D. | 130 mL |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
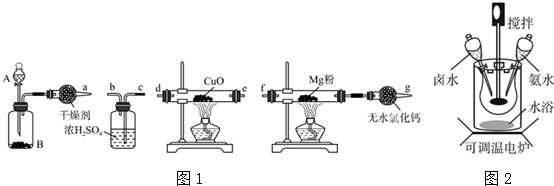
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
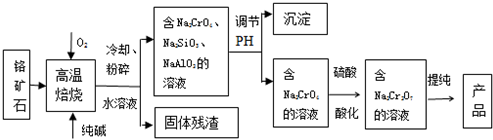
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含等物质的量的NaHC2O4和Na2C2O4的溶液:3c(Na+)═2[c(HC2O4-)+c(C2O42-)+c(H2C2O4)] | |
| B. | 等pH的氨水、KOH溶液、Ba(OH)2溶液中:c(NH4+)=c(K+)=c(Ba2+) | |
| C. | 加水稀释CH3COONa溶液,溶液中$\frac{c(C{H}_{3}COOH)c(O{H}^{-})}{c(C{H}_{3}CO{O}^{-})}$的值变小 | |
| D. | 25℃时,pH=4的盐酸与pH=4的醋酸溶液等体积混合后pH=4 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | pH=2的HA溶液与pH=12的MOH溶液任意比混合:c(H+)+c(M+)=c(OH-)+c(A-) | |
| B. | B氨水和盐酸混合后溶液呈酸性,溶液中可能存在:c(NH4+)>c(Cl-) | |
| C. | 在一定温度下,相同pH的硫酸和硫酸铁溶液中水电离出来的c(H+)分别是1.0×0×10-amol/L和是1.0×10-bmol/L,在此温度时,水的离子积为1.0×10-(a+b) | |
| D. | 常温下,0.1mol/L酸HA pH=3,0.1mol/L 碱BOH pH=13,则盐BA溶液的pH<7 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com