
短周期主族元素X、Y、Z、W在元素周期表中的位置关系如下图,下列推论合理的是
 A.若X、Y、Z、W中只有一种为金属元素,则W一定为铝元素
A.若X、Y、Z、W中只有一种为金属元素,则W一定为铝元素
B. 若W的核电荷数是Y的两倍,则W的氧化物可作半导体材料
C.若Z的核电荷数是Y的两倍,则X的氢化物水溶液显酸性
D. 若Y、W的简单阴离子都能破坏水的电离,则Z的简单阴离子也一定能破坏水的电离
 名师点拨卷系列答案
名师点拨卷系列答案科目:高中化学 来源: 题型:
褪黑素是一种内源性生物钟调节剂,在人体内由食物中的色氨酸转化得到。
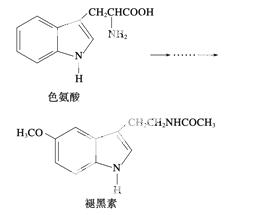
下列说法不正确的是 ( )
A.色氨酸分子中存在氨基和羧基,可形成内盐,具有较高的熔点
B.在色氨酸水溶液中,可通过调节溶液的pH使其形成晶体析出
C.在一定条件下,色氨酸可发生加聚反应
D.褪黑素与色氨酸结构相似,也具有两性化合物的特性
查看答案和解析>>
科目:高中化学 来源: 题型:
已知某温度下CH3COOH和NH3·H2O的电离常数相等,现向10mL浓度为0.1mo1·L-1的CH3COOH溶液中滴加相同浓度的氨水,在滴加过程中
A.水的电离程度始终增大
B.c(NH4+) / c (NH3·H2O)先增大再减小
C.c(CH3COOH)与c(CH3COO-)之和始终保持不变
D.当加入氨水的体积为10mL时,c(NH4+)=c(CH3COO-)
查看答案和解析>>
科目:高中化学 来源: 题型:
某芳香族化合物A,苯环上的一氯代物有两种,A完全燃烧只生成二氧化碳和水,一定条件下存在如图所示的转化关系(方框中Mr代表相对分子质量):
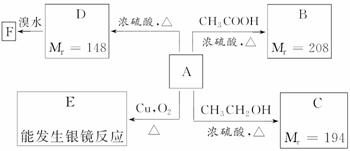
请回答下列问题:
(1)A的摩尔质量为________,在一定条件下B可能发生的化学反应的反应类型有________(填序号)。
①水解反应 ②取代反应 ③加成反应 ④消去反应
⑤加聚反应
(2)C的结构简式为____________________________________________________。
E的结构简式为_______________________________________________________。
(3)写出下列转化的化学方程式:
①A――→B: ____________________________________________________。
②D――→F: ____________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
工业制得的氮化铝(AlN)产品中常含有少量Al4C3、Al2O3、C等杂质。某同学设计了如下实验分别测定氮化铝(AlN)样品中AlN和Al4C3的质量分数(忽略NH3在强碱性溶液中的溶解)。
(1)实验原理
①Al4C3与硫酸反应可生成CH4;
②AlN溶于强酸产生铵盐,溶于强碱生成氨气,请写出AlN与NaOH溶液反应的化学方程式 。
(2)实验装置(如图所示)

(3)实验过程
①连接实验装置,检验装置的气密性。称得D装置的质量为yg,滴定管的读数为amL。
②称取xg AlN样品置于锥形瓶中;塞好胶塞,关闭活塞 ,打开活塞 ,通过分液漏斗加入稀硫酸,与烧瓶内物质充分反应。
③待反应进行完全后,关闭活塞 ,打开活塞 ,通过分液漏斗加入过量
(填化学式),与烧瓶内物质充分反应。
④ (填入该步应进行的操作)。
⑤记录滴定管的读数为bmL,称得D装置的质量为zg。
(4)数据分析
①AlN的质量分数为 。
②若读取滴定管中气体的体积时,液面左高右低,则所测气体的体积 (填“偏大”、“偏小”或“无影响”)。
③Al4C3的质量分数为 (该实验条件下的气体摩尔体积为Vm)。
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)有机物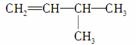 的系统名称是______________,将其在催化剂存在下完全氢化,所得烷烃的系统名称是____________。
的系统名称是______________,将其在催化剂存在下完全氢化,所得烷烃的系统名称是____________。
(2)有机物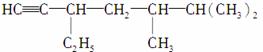 的系统名称是
的系统名称是
____________________,将其在催化剂存在下完全氢化,所得烷烃的系统名称是______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
过氧化钙可以用于改善地表水质,处理含重金属粒子废水和治理赤潮,也可用于应急供氧等。工业上生产过氧化钙的主要流程如下:
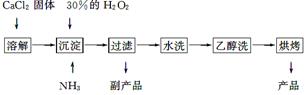
已知CaO2·8H2O呈白色,微溶于水,加热至350 ℃左右开始分解放出氧气。
(1)用上述方法制取CaO2·8H2O的化学方程式是______________________________;
(2)检验“水洗”是否合格的方法是___________________________________________;
(3)沉淀时常用冰水控制温度在0 ℃左右,其可能原因是______________________;
(4)测定产品中CaO2的含量的实验步骤:
第一步:准确称取a g产品于有塞锥形瓶中,加入适量蒸馏水和过量的b g KI晶体,再滴入少量2 mol·L-1的H2SO4溶液,充分反应。
第二步:向上述锥形瓶中加入几滴淀粉溶液。
第三步:逐滴加入浓度为c mol·L-1的Na2S2O3溶液至反应完全,消耗Na2S2O3溶液V mL。
【已知:I2+2S2O32-=2I-+S4O62-】
①第一步发生的反应的化学方程式为 ;
CaO2的质量分数为____________(用字母表示);
②某同学第一步和第二步的操作都很规范,第三步滴速太慢,这样测得的CaO2的质量分数可能________(填“不受影响”、“偏低”或“偏高”),原因是___________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com