
25 ℃时,电离平衡常数:
化学式 | CH3COOH | H2CO3 | HClO | |
电离平衡常数 | 1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 | |
回答下列问题:
(1)下列四种离子结合质子的能力由大到小的顺序是___________(填编号)
a.CO32- b.ClO- c.CH3COO- d.HCO3-;
(2)下列反应不能发生的是__________
A.CO32-+CH3COOH=CH3COO-+CO2↑+H2O
B.ClO-+CH3COOH=CH3COO-+HClO
C.CO32-+HClO=CO2↑+H2O+ClO-
D.2ClO-+CO2+H2O=CO32-+2HClO
(3)用蒸馏水稀释0.10 mol·L-1的醋酸,则下列各式表示的数值随水量的增加而增大的是___________
A.c(CH3COOH)/c(H+) B.c(CH3COO-)/c(CH3COOH) C.c(H+)/ KW D.c(H+)/c(OH-)

(4)体积为10 mL pH=2的醋酸溶液与一元酸HX分别加水稀释至1 000 mL,稀释过程pH变化如图,则HX的电离平衡常数___________(填“大于”、“等于”或“小于”)醋酸的平衡常数,稀释后,HX溶液中水电离出来的 c(H+)______________醋酸溶液中水电离出来的c(H+)(填“大于”、“等于”或 “小于”)
科目:高中化学 来源:2017届河北省高三上月考三化学试卷(解析版) 题型:选择题
下列有关胶体的说法正确的是( )
A.胶体不一定是混合物
B.胶体与溶液的本质区别是有丁达尔活应
C.将饱和氯化铁溶液滴入稀氢氧化钠溶液中加热,可得氢氧化铁胶体
D.胶休属于介稳体系
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江苏省高二上期中选修化学卷(解析版) 题型:选择题
利用下列实验装置能完成相应实验的是
A.装置①测定化学反应速率 B.装置②制取并吸收HCl
C.装置③量取8.5mL的稀硫酸 D.装置④模拟铁的腐蚀
查看答案和解析>>
科目:高中化学 来源:2017届湖南省高三上月考三化学试卷(解析版) 题型:选择题
一定温度下,在三个体积均为1.0L的恒容密闭容器中发生反应:2CH3OH(g) CH3OCH3(g)+H2O(g),则下列说法正确的是
CH3OCH3(g)+H2O(g),则下列说法正确的是
容器 编号 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | |
CH3OH(g) | CH3OCH3(g) | H2O(g) | ||
I | 387 | 0.20 | 0.080 | 0.080 |
Ⅱ | 387 | 0.40 | ||
Ⅲ | 207 | 0.20 | 0.090 | 0.090 |
A.该反应的正反应为放热反应
B.达到平衡时,容器I中的CH3OH体积分数比容器Ⅱ的小
C.容器I中反应达到平衡所需时间比容器Ⅲ中的长
D.若起始时向容器I中充入CH3OH 0.1mol、CH3OCH3 0.15mol和H2O 0.10mol,则反应将向逆反应方向进行
查看答案和解析>>
科目:高中化学 来源:2017届湖南省高三上月考三化学试卷(解析版) 题型:选择题
RFC是一种将水电解技术与氢氧燃料电池技术向结合的可充电电池。下图为RFC工作原理示意图,下列有关说法正确的是
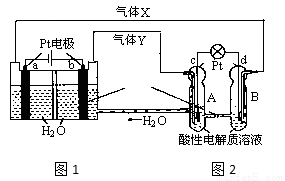
A.图1把化学能转化为电能,图2把电能转化为化学能,水得到了循环使用
B.当有0.1mol电子转移时,a极产生0.56LO2(标准状况下)
C.c极上发生的电极反应是:O2+4H++4e-=2H2O
D.图2中电子从c极流向d极,提供电能
查看答案和解析>>
科目:高中化学 来源:2017届宁夏高三上期中化学试卷(解析版) 题型:选择题
已知图一表示的是可逆反应CO(g)+H2(g)  C(s)+H2O(g) ΔH>0的化学反应速率(v)与时间(t)的关系,图二表示的是可逆反应2NO2(g)
C(s)+H2O(g) ΔH>0的化学反应速率(v)与时间(t)的关系,图二表示的是可逆反应2NO2(g)  N2O4(g) ΔH<0的浓度(c)随时间t的变化情况。下列说法中正确的是( )
N2O4(g) ΔH<0的浓度(c)随时间t的变化情况。下列说法中正确的是( )

A.图一t2时改变的条件可能是升高了温度或增大了压强
B.若图一t2时改变的条件是增大压强,则反应的ΔH增大
C.图二t1时改变的条件可能是升高了温度或增大了压强
D.若图二t1时改变的条件是增大压强,则混合气体的平均相对分子质量将减小
查看答案和解析>>
科目:高中化学 来源:2017届宁夏高三上期中化学试卷(解析版) 题型:选择题
关于某无色溶液中所含离子的鉴别,下列判断正确的是 ( )
A.加入AgNO3溶液,生成白色沉淀,加稀盐酸沉淀不溶解时,可确定有Cl-存在
B.通入Cl2后,溶液变为深黄色,加入淀粉溶液后溶液变蓝,可确定有I-存在
C.加入Ba(NO3)2溶液,生成白色沉淀,加稀盐酸后沉淀不溶解时,可确定有SO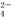 存在
存在
D.加入稀盐酸,生成的气体能使澄清石灰水变浑浊,可确定有CO 存在
存在
查看答案和解析>>
科目:高中化学 来源:2017届辽宁省高三上期中化学试卷(解析版) 题型:填空题
I.用零价铁(Fe)去除水体中的硝酸盐(NO3-)已成为环境修复研究的热点之一。
(1)Fe还原水体中NO3-的反应原理如图所示。
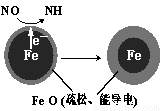
正极的电极反应式是 。
(2)将足量铁粉投入水体中,经24小时测定NO3-的去除率和pH,结果如下:
初始pH | pH=2.5 | pH=4.5 |
NO3-的去除率 | 接近100% | <50% |
24 | 接近中性 | 接近中性 |
铁的最终物质形态 |
|
|
pH=4.5时,NO3-的去除率低。其原因是 。
(3)实验发现:在初始pH=4.5的水体中投入足量铁粉的同时,补充一定量的Fe2+可以明显提高NO3-的去除率。对Fe2+的作用提出两种假设:
Ⅰ.Fe 2+直接还原NO3-;Ⅱ.Fe2+破坏FeO(OH)氧化层。
2+直接还原NO3-;Ⅱ.Fe2+破坏FeO(OH)氧化层。
① 对比实验,结果如图所示,可得到的结论是 。
②同位素示踪法证实Fe2+能与FeO(OH)反应生成Fe3O4。结合该反应的离子方程式,解释加入Fe2+提高NO3-去除率的原因: 。
II.高铁酸钠Na2FeO4 是一种新型净水剂。
(4)高铁酸钠主要通过如下反应制取:2Fe(OH)3+3NaClO+4NaOH= 2Na2FeO4+3X+5H2O,则X的化学式为__________。
(5)高铁酸钠具有强氧化性,与水反应生成Fe(OH)3胶体能够吸附水中悬浮杂质,请写出高铁酸钠与水反应的离子方程式 。
查看答案和解析>>
科目:高中化学 来源:2017届黑龙江牡丹江高级中学高三上期中化学卷(解析版) 题型:填空题
(1)下列有关实验操作或结果的说法中正确的是 (填字母)。
A.滴定时,眼睛应始终注视滴定管内液面的变化
B.滴定实验都需要指示剂
C.酸碱中和滴定之前,锥形瓶用蒸馏水洗净即可,不能用待测液润洗
D.用pH试纸测量某溶液的pH时要先将试纸润湿
E.滴定管经蒸馏水洗净后,直接注入标准液,将使测得的待测液浓度偏高
F.用广泛pH试纸测量H2SO4溶液的pH时,测得pH=3.2
G.测定酸碱滴定曲线:开始时测试和记录的间隔可稍小些,滴定至终点附近则要大些
(2)NaHSO3溶液显 性,原因 (用化学用语和必要的文字说明),该溶液中离子浓度由大到小排序 。
(3)t℃时,水的离子积KW=1×10-13,pH=11的NaOH溶液a L与pH=1的稀硫酸b L混合(混合液体积变化忽略不计) 若所得混合液的pH=2,则a:b= 。
(4)已知PbI2的Ksp=7.0×10-9,将7.5×10-3mol/L的KI与一定浓度的Pb(NO3)2溶液按2∶1体积比混合,则生成PbI2沉淀所需Pb(NO3)2溶液的最小浓度为 (填序号)。
A.8.4×10-4 B.5.6×10-4 C.4.2×10-4 D.2.8×10-4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com