
下列事实不能用勒夏特列原理解释的是( )
|
| A. | 红棕色NO2加压后颜色先变深后变浅 |
|
| B. | 实验室中常用排饱和食盐水的方法收集氯气 |
|
| C. | SO2催化氧化成SO3的反应,使用过量的空气以提高二氧化硫的利用率 |
|
| D. | 压缩H2与I2(g)反应的平衡混合气体,颜色变深 |
考点:
化学平衡的影响因素.
专题:
化学平衡专题.
分析:
勒夏特列原理为:如果改变影响平衡的条件之一,平衡将向着能够减弱这种改变的方向移动.使用勒夏特列原理时,该反应必须是可逆反应,否则勒夏特列原理不适用.
解答:
解:A、红棕色NO2加压后,化学平衡为2NO2⇌N2O4,加压浓度增大气体颜色加深,但破坏正向进行,所以颜色先变深后变浅,能用勒夏特列原理解释,故A不符合;
B、实验室中常用排饱和食盐水的方法收集氯气,氯气和水反应是化学平衡,Cl2+H2O⇌H++Cl﹣+HClO,饱和食盐水中氯离子浓度大,平衡逆向进行,减少氯气溶解度,能用勒夏特列原理解释,故B不符合;
C、SO2催化氧化成SO3的反应,使用过量的空气,增大反应物浓度,平衡正向进行,提高二氧化硫的利用率,能用勒夏特列原理解释,故C不符合;
D、压缩H2与I2(g)反应的平衡混合气体,化学平衡反应前后是气体体积不变的反应,H2+I2⇌2HI,颜色变深是因为体积减小,物质浓度增大,不能用勒夏特列原理解释,故D符合;
故选D.
点评:
本题考查了勒夏特列原理的使用条件,难度不大,注意把握影响平衡移动的因素以及使用勒夏特列原理的前提.


 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:
下表是元素周期表的一部分,其中每个数字序号代表一种短周期元素.
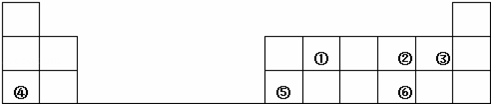
请按要求回答下列问题:
(1)写出②的元素名称 ;②元素形成氢化物的电子式 或
(2)将①、②和③三种元素相比较,非金属性最强的是 (填元素符号);
(3)元素⑥的氢化物的化学式为 ;
(4)元素④和元素⑤的最高价氧化物对应的水化物在溶液中相互反应的离子方程式是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
|
| A. | PH小于7时一定为酸性 |
|
| B. | 水离子积Kw与 温度、酸碱性有关 |
|
| C. | c(H+)=c(OH﹣)的溶液一定为中性溶液 |
|
| D. | 加入酸或碱促进水电离 |
查看答案和解析>>
科目:高中化学 来源: 题型:
关于强弱电解质及非电解质的组合完全正确的是( )
| A | B | C | D | |
| 强电解质 | NaCl | H2SO4 | CaCO3 | HNO3 |
| 弱电解质 | HF | 氨水 | HClO | HI |
| 非电解质 | Cl2 | 蔗糖 | C2H5OH | SO2 |
|
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:
将纯水加热至较高温度,下列叙述正确的是( )
|
| A. | 水的离子积变大、pH变小、呈酸性 |
|
| B. | 水的离了积不变、pH不变、呈中性 |
|
| C. | 水的离子积变小、pH变大、呈碱性 |
|
| D. | 水的离子积变大、pH变小、呈中性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
pH=2的A、B两种酸溶液各1mL,分别加水稀释到1L(其pH与溶液体积V的关系如图所示),下列说法正确的是( )
①a=5时,A是强酸,B是弱酸;
②若A、B都是弱酸,则5>a>2;
③稀释后,A酸溶液的酸性比B酸溶液强;
④A、B两种酸溶液的物质的量浓度一定相等.
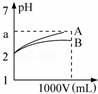
|
| A. | ①② | B. | ③④ | C. | ①③ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
已知元素X的基态原子最外层电子排布为nsn﹣1npn+2,则它最高价氧化物对应的水化物的酸根离子是( )
|
| A. | RO | B. | RO43﹣ | C. | RO | D. | RO32﹣ |
查看答案和解析>>
科目:高中化学 来源: 题型:
700℃时,向容积为2L的密闭容器中充入一定量的CO和H2O,发生反应:CO(g)+H2O(g)⇌CO2+H2(g)反应过程中测定的部分数据见下表(表中t1>t2):
| 反应时间/min | n(CO)/mol | n(H2O)/mol |
| 0 | 1.20 | 0.60 |
| t1 | 0.80 | |
| t2 | 0.20 |
依据题意回答下列问题:
(1)反应在t1min内的平均速率为v(H2)= mol•L﹣1•min﹣1
(2)保持其他条件不变,起始时向容器中充入0.60molCO和1.20molH2O,到达平衡时,n(CO2)= mol.
(3)保持其他条件不变,向平衡体系中再通入0.20molH2O,与原平衡相比,达到新平衡时CO转化率 (填“增大”或“减小”或“不变”),H2O的体积分数 (填“增大”或“减小”或“不变”).
(4)温度升至800℃,上述反应平衡常数为0.64,则正反应为 反应(填“放热”或“吸热”).
查看答案和解析>>
科目:高中化学 来源: 题型:
由水电离产生的c(H+)和c(OH﹣)的乘积为1×10﹣18的溶液里,可能大量共存的离子组( )
|
| A. | NH4+、Na+、Cl﹣、I﹣ | B. | Na+、K+、Fe3+、SCN﹣ |
|
| C. | Na+、Al3+、Cl﹣、AlO2﹣ | D. | Na+、K+、Cl﹣、HCO3﹣ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com