
| A. | 该反应的正反应是放热反应 | |
| B. | T0时,该反应的平衡常数为$\frac{1}{3}$ | |
| C. | 反应时各物质的反应速率关系为:2v (X)=2v (Y)=v (Z) | |
| D. | 图a中反应达到平衡时,Y的转化率为37.5% |
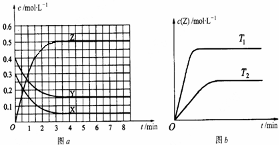
分析 由图a可知,X、Y浓度减小,为反应物,Z的浓度增大,为生成物,且最终X、Y浓度不变,为可逆反应,平衡时,X、Y、Z的物质的量浓度变化量分别为0.25mol/L、0.25mol/L、0.5mol/L,化学计量数之比等于物质的量变化量之比,即X、Y、Z的化学计量数之比为0.25:0.25:0.5=1:1:2,则反应方程式为:X(g)+Y(g)?2Z(g).
A.由图b可知,温度为T1先到达平衡,所以T1>T2,温度越高,平衡时Z的物质的量浓度越大,说明升高温度平衡向正反应移动;
B.由图a可知,X、Y浓度减小,为反应物,Z的浓度增大,为生成物,且最终X、Y浓度不变,为可逆反应,平衡时,X、Y、Z的物质的量浓度变化量分别为0.25mol/L、0.25mol/L、0.5mol/L,则反应方程式为:X(g)+Y(g)?2Z(g),再根据K=$\frac{{c}^{2}(Z)}{c(X)×c(Y)}$计算平衡常数;
C.根据速率之比等于物质的量变化量之比进行计算判断;
D.由图a可知,Y的起始浓度为0.4mol/L,平衡时Y的物质的量浓度为0.15mol/L,Y的浓度变化为0.25mol/L,结合转化率定义计算.
解答 解:由图a可知,X、Y浓度减小,为反应物,Z的浓度增大,为生成物,且最终X、Y浓度不变,为可逆反应,平衡时,X、Y、Z的物质的量浓度变化量分别为0.25mol/L、0.25mol/L、0.5mol/L,化学计量数之比等于物质的量变化量之比,即X、Y、Z的化学计量数之比为0.25:0.25:0.5=1:1:2,则反应方程式为:X(g)+Y(g)?2Z(g).
A.由图b可知,温度为T1先到达平衡,所以T1>T2,温度越高,平衡时Z的物质的量浓度越大,说明升高温度平衡向正反应移动,升高温度平衡向吸热反应移动,故正反应为吸热反应,故A错误;
B.平衡常数K=$\frac{{c}^{2}(Z)}{c(X)×c(Y)}$=$\frac{0.{5}^{2}}{0.05×0.15}$=$\frac{100}{3}$,故B错误;
C.由上述分析可知反应为X(g)+Y(g)?2Z(g),速率之比等于物质的量变化量之比,所以反应时各物质的反应速率大小关系为:2v(X)=2v(Y)=v(Z),故C正确;
D.由图a可知,Y的起始浓度为0.4mol/L,平衡时Y的物质的量浓度为0.15mol/L,Y的浓度变化为0.25mol/L,所以Y的转化率为$\frac{0.25mol/L}{0.4mol/L}$=62.5%,故D错误,
故选:C.
点评 本题考查化学平衡计算与影响因素、化学平衡图象问题等,难度中等,侧重考查学生读图获取信息能力,注意平衡图象中先拐先平数值大原则与定一议二原则.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③④ | B. | ①②③④ | C. | ②③④⑤ | D. | ①②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 7.1gCl2与足量的氢氧化钠溶液反应转移的电子数一定为0.2NA | |
| B. | 在常温常压下,11.2 升氯气含有的分子数为0.5NA | |
| C. | 常温常压下,32 g O2和O3的混合气体所含原子数为2NA | |
| D. | 1 molFe与足量的Cl2反应转移的电子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 美国化学家设计出以甲烷等碳氢化合物为燃料的新型电池,其成本大大低于以氢为燃料的传统电池.燃料电池使用气体燃料和氧气直接反应产生电能,其效率高、污染低,是一种很有前途的能源利用方式.
美国化学家设计出以甲烷等碳氢化合物为燃料的新型电池,其成本大大低于以氢为燃料的传统电池.燃料电池使用气体燃料和氧气直接反应产生电能,其效率高、污染低,是一种很有前途的能源利用方式.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
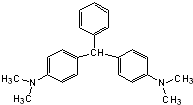 无色孔雀石绿(结构简式如图所示)曾被用作水产养殖业的杀虫剂(鱼药).因为具有潜在致癌性,已被禁止用作鱼药,下列关于无色孔雀石绿的叙述中,正确的是( )
无色孔雀石绿(结构简式如图所示)曾被用作水产养殖业的杀虫剂(鱼药).因为具有潜在致癌性,已被禁止用作鱼药,下列关于无色孔雀石绿的叙述中,正确的是( )| A. | 分子中所有的碳原子可能在同一平面上 | |
| B. | 无色孔雀石绿与氢气完全加成后的产物的核磁共振氢谱中有7个峰 | |
| C. | 无色孔雀石绿可与溴水中的溴发生加成反应 | |
| D. | 在一定条件下,1mol无色孔雀石绿可以和9mol氢气发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在含等物质的量的Fe2+、Ag+、Cu2+、H+的溶液中加入Zn:Ag+、Cu2+、H+、Fe2+ | |
| B. | 在含等物质的量的AlO2-、OH-、CO32-溶液中,逐滴加入盐酸:AlO2-、Al(OH)3、OH-、CO32- | |
| C. | 在含等物质的量的Ba(OH)2、KOH的溶液中通入CO2:KOH、Ba(OH)2、BaCO3 | |
| D. | 在含等物质的量的FeBr2、FeI2的溶液中缓慢通入Cl2:I-、Br-、Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 (1,3-环己二烯)的各步反应方程式
(1,3-环己二烯)的各步反应方程式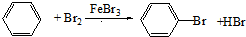
 +3H2$\stackrel{一定条件下}{→}$
+3H2$\stackrel{一定条件下}{→}$
 +NaOH$→_{△}^{乙醇}$
+NaOH$→_{△}^{乙醇}$ +H2O+NaBr
+H2O+NaBr +Br2→
+Br2→
 +2NaOH$→_{△}^{乙醇}$
+2NaOH$→_{△}^{乙醇}$ +2NaBr+2H2O.
+2NaBr+2H2O.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com