
| 2.24L |
| 22.4L/mol |
| 23.3g |
| 233g/mol |


科目:高中化学 来源: 题型:
| A、焰色反应为化学变化 |
| B、所有金属及其化合物灼烧时火焰均有颜色 |
| C、NaCl与Na2CO3灼烧时火焰颜色相同 |
| D、焰色反应均应透过蓝色钴玻璃观察 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 化学键 | A-A | B-B | A-B |
| 生成1mol化学键时放出的能量 | 436kJ?mol-1 | 243kJ?mol-1 | 431kJ?mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 编号 | a的取值范围 | 产物的化学式(或离子符号) |
| A | a≤1/6 | I2 Br- H2O |
| B | 1/6<a<1/5 | |
| C | a=1/5 | I2 Br2 H2O |
| D | 1/5<a<6/5 | I2 IO3- Br2 H2O |
| E | a≥6/5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
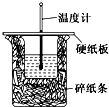 50mL 0.50mol/L盐酸与50mL 0.55mol/L NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
50mL 0.50mol/L盐酸与50mL 0.55mol/L NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
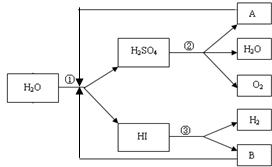 人类研究氢能源从未间断过,而热化学循环分解水制氢气是在水反应体系中加入一种中间物,经历不同的反应阶段,最终将水分解为氢气和氧气,这是一种节约能源、节省反应物料的技术,如图是一个热化学循环制氢气法的流程:
人类研究氢能源从未间断过,而热化学循环分解水制氢气是在水反应体系中加入一种中间物,经历不同的反应阶段,最终将水分解为氢气和氧气,这是一种节约能源、节省反应物料的技术,如图是一个热化学循环制氢气法的流程:查看答案和解析>>
科目:高中化学 来源: 题型:
| 3 |
| 2 |
| 1 |
| 2 |
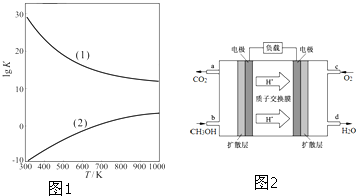
查看答案和解析>>
科目:高中化学 来源: 题型:
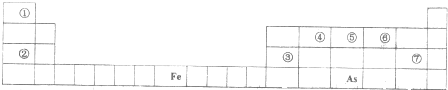
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com