
| A. | 0.1mol/L甲酸溶液的c(H+)=10-3mol/L | |
| B. | 甲酸以任意比与水互溶 | |
| C. | 10mL 1mol/L甲酸恰好与10mL 1mol/L NaOH溶液完全反应 | |
| D. | 甲酸溶液的导电性比一元强酸溶液的弱 |
分析 A.0.1mol/L甲酸溶液中电离出的氢离子浓度为10-3mol/L,证明甲酸部分电离;
B.甲酸的水溶性大小与强弱电解质没有必然关系;
C.甲酸与氢氧化钠发生中和反应,无法判断电解质的强弱;
D.没有指出浓度相同,则无法判断甲酸是否为弱电解质.
解答 解:A.0.1mol/L甲酸溶液的c(H+)=10-3mol/L,说明甲酸在溶液中只能部分电离出氢离子,从而证明甲酸为弱酸,故A正确;
B.甲酸以任意比与水互溶,无法判断甲酸为弱电解质还是弱电解质,故B错误;
C.10mL 1mol/L甲酸恰好与10mL 1mol/L NaOH溶液完全反应,二者发生中和反应,无法判断甲酸是强电解质还是弱电解质,故C错误;
D.溶液导电性与离子浓度大小有关,没有指出浓度相同,则无法判断甲酸为弱电解质,故D错误;
故选A.
点评 本题考查了强电解质的判断方法,题目难度中等,明确强电解质、弱电解质的概念为解答关键,注意电解质强弱与水溶性、导电性没有必然关系,试题侧重基础知识的考查,培养了学生的灵活应用能力.


科目:高中化学 来源:2016-2017学年重庆市高一上10月月考化学试卷(解析版) 题型:选择题
下列实验操作能达到实验目的的是
选项 | 实验目的 | 实验操作 |
A | 除去CO中少量的CO2 | 通过足量灼热CuO |
B | 除去CuCO3溶液中的少量 CuO | 加入足量稀H2SO4后,过滤 |
C | 鉴别澄清石灰水和NaOH溶液 | 加入稀HCl |
D | 鉴别硬水和软水 | 加入肥皂水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 700℃ | 900℃ | |
| K1 | 1.47 | 2.15 |
| K2 | 2.38 | 1.67 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu2+ NO3- SO42- Fe3+ | |
| B. | Cl- S2- Na+ K+ | |
| C. | Cl- Na+ NO3- SO42- | |
| D. | SO32- NH4+ K+ Mg2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 有4种不同的伸展方向 | B. | 有5种不同能量的电子 | ||
| C. | 有5种不同的运动范围 | D. | 有14种不同运动状态的电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10mol 10% | B. | 20mol 20% | C. | 20mol 40% | D. | 30mol 80% |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
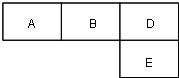 M、A、B、D、N、E五种短周期元素的原子序数依次增大.M元素的单质是自然界最轻的气体,N元素的原子半径是所在周期原子半径最大的.A、B、D、E分别在如图(周期表的一部分)占有相应的位置,它们的原子序数之和为37.
M、A、B、D、N、E五种短周期元素的原子序数依次增大.M元素的单质是自然界最轻的气体,N元素的原子半径是所在周期原子半径最大的.A、B、D、E分别在如图(周期表的一部分)占有相应的位置,它们的原子序数之和为37. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 8种 | B. | 12种 | C. | 16种 | D. | 32种 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com