
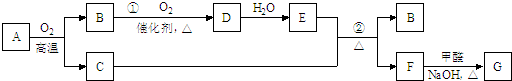
分析 F与甲醛/NaOH在加热条件下反应生成G为砖红色沉淀,则G为Cu2O,F为铜盐,A为某金属矿物的主要成分,与氧气反应得到C与B,B氧化得到D,D与水反应得到E,单质C可与E的浓溶液发生反应得到B与F,则A为Cu2S、B为SO2、C为Cu,D为SO3、E为H2SO4,F为CuSO4,据此解答.
解答 解:F与甲醛/NaOH在加热条件下反应生成G为砖红色沉淀,则G为Cu2O,F为铜盐,A为某金属矿物的主要成分,与氧气反应得到C与B,B氧化得到D,D与水反应得到E,单质C可与E的浓溶液发生反应得到B与F,则A为Cu2S、B为SO2、C为Cu,D为SO3、E为H2SO4,F为CuSO4.
(1)由上述分析可知,B为SO2,G为Cu2O,故答案为:SO2;Cu2O;
(2)反应②的化学方程式是:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,
故答案为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;
(3)用电解法提纯金属铜的方法是将粗铜作为电解池的阳极,精铜作为电解池的阴极,一般用CuSO4溶液作电解质溶液;MnO2是碱性锌锰电池的正极材料,电池放电时,正极是二氧化锰得到电子,则电极反应式为:MnO2+H2O+e-=MnO(OH)+OH-,
故答案为:CuSO4溶液;粗铜;MnO2+H2O+e-=MnO(OH)+OH-;
(4)在一个固定容积为2L的密闭容器中充入0.20mol的SO2和0.10mol的O2,半分钟后达到平衡,测得容器中含SO3为0.18mol,v(SO3)=$\frac{\frac{0.18mol.L}{5L}}{0.5min}$=0.072mol/(L•min),速率之比等于化学计量数之比,故v(O2 )=$\frac{1}{2}$v(SO3)=$\frac{1}{2}$×0.072mol/(L•min)=0.036mol/(L•min);
若继续通入0.20mol SO2和0.10mol O2,压强增强,平衡向正反应移动,反应转化率增大,再次达到新平衡后,SO3的物质的量大于0.18mol×2=0.36mol,若0.4molSO2与0.2molO2完全反应,可以生成0.4molSO3,反应物不能完全转化,故达SO3小于0.4mol,即SO3的物质的量介于0.36mol和0.40mol之间;
故答案为:0.036;向正反应方向;0.36mol~0.4mol之间;
(5)F为CuSO4,G为Cu2O,F→G转化过程中,甲醛参与反应的化学方程式为:HCHO+4CuOH)2+2NaOH$\stackrel{△}{→}$Na2CO3+2Cu2O+6H2O↓,
故答案为:HCHO+4CuOH)2+2NaOH$\stackrel{△}{→}$Na2CO3+2Cu2O+6H2O↓.
点评 本题考查无机物推断,“F与甲醛/NaOH反应生成砖红色沉淀”是推断突破口,需要学生熟练掌握元素化合物知识及中学常见化学工业,(4)中注意利用极限法解答.


科目:高中化学 来源: 题型:解答题
 实验室需要0.1mol/LNaOH溶液450mL和0.5mol/L的硫酸溶液500mL.根据这两种溶液的配制情况回答下列问题.
实验室需要0.1mol/LNaOH溶液450mL和0.5mol/L的硫酸溶液500mL.根据这两种溶液的配制情况回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,11.2 LCO2所含的原子数为1.5NA | |
| B. | 标准状况下,22.4 L CCl4中所含分子数为NA | |
| C. | 标准状况下,18g水所含原子数为NA | |
| D. | 常温常压下,48 g O2与O3混合物含有的氧原子数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;D
;D .
.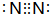 ,氢化物
,氢化物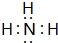 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子最外层电子数等于或大于4的元素一定是非金属元素 | |
| B. | 原子最外层只有2个电子的元素一定是金属元素 | |
| C. | 最外层电子数比次外层电子数多的元素一定位于第二周期 | |
| D. | 某元素的离子最外层电子数与次外层电子数相同,该元素一定位于第三周期 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙元素的族序数比甲元素的族序数大 | |
| B. | 甲、丙元素最高价氧化物对应水化物的酸性强弱顺序为:甲<丙 | |
| C. | 原子半径由大到小的顺序为:丙>甲>乙 | |
| D. | 含乙元素的化合物数目比含甲或丙元素的化合物数目多 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na、Mg、Al还原性依次减弱 | B. | Cl2、Br2、I2氧化性依次增强 | ||
| C. | Be、Mg、Ca与盐酸反应越来越剧烈 | D. | P、S、Cl最高正价依次升高 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 将废旧电池扔入垃圾桶 | B. | 将实验室废液集中进行无害化处理 | ||
| C. | 将造纸厂的污水直接排放 | D. | 夏季将空调温度设置在26℃以上 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com