
【题目】下列有关说法正确的是
A.电解精炼铜时,电解液CuSO4溶液的物质的量浓度不变
B.NaClO溶液中通入少量CO2后,ClO-水解程度增大,溶液碱性增强
C.SO3(g)+H2O(l)=H2SO4(aq)在常温下能自发进行,则该反应的△H<0
D.0.1 mo1·L-1CH3COOH溶液加水稀释后,溶液中![]() 的值减小
的值减小
科目:高中化学 来源: 题型:
【题目】某学习小组利用二氧化氯![]() 制备消毒剂、漂白剂亚氯酸钠
制备消毒剂、漂白剂亚氯酸钠![]() ,有关反应原理:
,有关反应原理:![]() 放热反应
放热反应![]()
实验一、制备![]() 晶体
晶体
选择如图所示装置设计实验制备亚氯酸钠晶体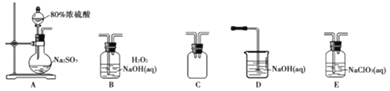
已知:饱和![]() 溶液析出晶体与度关系如下表所示:
溶液析出晶体与度关系如下表所示:
温度 |
|
|
|
品体成分 |
|
|
|
⑴装置连接顺序:![]() ______
______
⑵C装置的作用是______D装置作用是______
⑶A装置中选择![]() 浓硫酸的理由是______
浓硫酸的理由是______
⑷写出E装置中发生反应的离子方程式______
⑸对B装置中溶液采用结晶法提取无水亚氯酸钠晶体,操作分别为蒸发结晶、趁热过滤、用![]() 左右热水洗涤、低于
左右热水洗涤、低于![]() 条件下干燥,得到成品,蒸发结晶时控制温度为______
条件下干燥,得到成品,蒸发结晶时控制温度为______
实验二、测定产品纯度
⑹准确称量/span>ag产品,加入适量蒸馏水和过量的KI晶体,在酸性条件下发生反应:![]() ,将所得混合溶液稀释成250mL待测液。取
,将所得混合溶液稀释成250mL待测液。取![]() 待测液于锥形瓶,加入淀粉溶液作指示剂,用
待测液于锥形瓶,加入淀粉溶液作指示剂,用![]() 标准
标准![]() 溶液滴定至终点,测得消耗
溶液滴定至终点,测得消耗![]() 标准溶液的体积为
标准溶液的体积为![]() (已知:
(已知:![]() )
)
![]() 该产品纯度为______(只要求列出计算式)
该产品纯度为______(只要求列出计算式)
![]() 若滴定前滴定管尖嘴有气泡,滴定终点时尖嘴气泡消失,则测得结果______(填“偏高偏低”或“无影响”)
若滴定前滴定管尖嘴有气泡,滴定终点时尖嘴气泡消失,则测得结果______(填“偏高偏低”或“无影响”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以淀粉为基本原料可制备许多物质,如:
![]()
下列有关说法正确的是( )。
A.淀粉与纤维素互为同分异构体
B.反应⑤是取代反应
C.反应①是氧化反应
D.在加热条件下,可用银氨溶液鉴别葡萄糖和乙醇
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过二硫酸铵[(NH4)2S2O8]是一种常用的氧化剂和漂白剂。一种以辉铜矿(主要成分为Cu2S,且杂质不参与下列流程中的反应)为原料制备过二硫酸铵的流程如图所示:
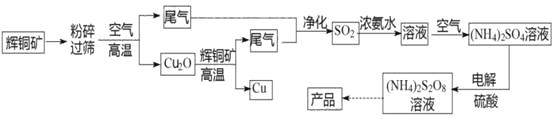
请回答下列问题:
(1)矿石“粉碎”的目的是________
(2)Cu2O和辉铜矿在高温下反应的化学方程式为________。在该反应中,n(氧化剂):n(还原剂)=________。
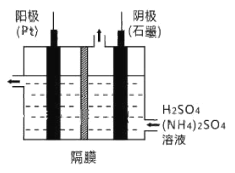
(3)工业上,常采用电解法制取(NH4)2S2O8,其装置如下图所示。则电解时,阳极的电极反应式为:________。当电路中转移2.5mol电子时,阴极产生________(填数值)mol________(填物质)。
(4)从过二硫酸铵溶液中获得过二硫酸铵晶体,需采用蒸发浓缩、降温结晶、________、________、干燥等操作。
(5)过二硫酸铵常用于检验废水中的Cr3+是否超标,如果超标,溶液会变成橙色(还原产物为SO42-),写出该反应的离子方程式________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下钛的化学活性很小,在较高温度下可与多种物质反应。工业上由金红石(含TiO2大于96%)为原料生产钛的流程如下:
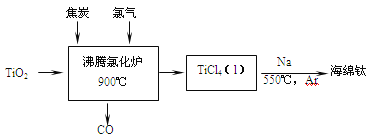
(1)TiCl4遇水强烈水解,写出其水解的化学方程式___________________。
(2)①若液氯泄漏后遇到苯,在钢瓶表面氯与苯的反应明显加快,原因是___________。
②Cl2含量检测仪工作原理如下图,则Cl2在Pt电极放电的电极反应式为_______。
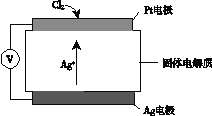
③实验室也可用KClO3和浓盐酸制取Cl2,方程式为:KClO3+ 6HCl(浓) =" KCl" + 3Cl2↑+ 3H2O。
当生成6.72LCl2(标准状况下)时,转移的电子的物质的量为____mol。
(3)一定条件下CO可以发生如下反应:4H2(g)+2CO(g)![]() CH3OCH3(g)+H2O(g) △H。
CH3OCH3(g)+H2O(g) △H。
①该反应的平衡常数表达式为K=_____________。
②将合成气以n(H2)/n(CO)=2通入1 L的反应器中,CO的平衡转化率随温度、压强变化关系如图所示,下列判断正确的是___________(填序号)。
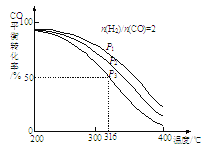
a.△H <0
b.P1<P2<P3
c.若在P3和316℃时,起始时n(H2)/n(CO)=3,则达到平衡时,CO转化率小于50%
③采用一种新型的催化剂(主要成分是Cu-Mn的合金),利用CO和H2制备二甲醚(简称DME)。观察下图回答问题。
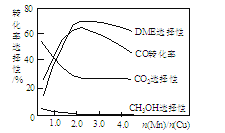
催化剂中n(Mn)/n(Cu)约为___________时最有利于二甲醚的合成。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,下列有关电解质溶液中微粒的物质的量浓度关系不正确的是
A.等浓度的①(NH4)2SO4溶液、②NH4HCO3溶液、③NH4Cl溶液中的c(![]() ):①>③>②
):①>③>②
B.等体积pH=a的醋酸与pH=b的NaOH溶液(a+b=14)充分混合时,可能有:c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
C.已知Ka(HClO)=3.0×10-8,Ka(HCN)=6.2×10-10,等体积、等浓度的NaClO、NaCN溶液中,前者中的离子总数小于后者中的离子总数
D.向20mL氨水中加入10mL等浓度的盐酸,有c(![]() )-c(NH3H2O)=2[c(OH-)-c(H+)]
)-c(NH3H2O)=2[c(OH-)-c(H+)]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钼(Mo)是一种过渡金属元素,它具有强度高、熔点高、耐腐蚀等优点,被广泛应用于钢铁、石油、化工、电气等领域。钼酸钠晶体(Na2MoO42H2O)是一种新型水处理剂。某化学兴趣小组利用废钼催化剂(主要成分为MoS2,含少量Cu2S、FeS2)回收Mo并制备钼酸钠晶体,其主要流程如图所示:
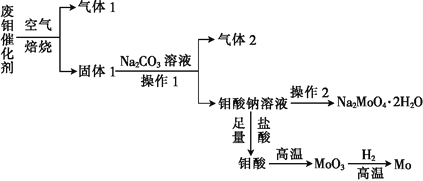
回答下列问题:
(1)可以提高焙烧效率的措施有__________________(填一条即可)。MoS2中的钼元素在空气中焙烧,很容易被氧化成MoO3,若生成0.1molMoO3,则反应中转移电子的数目为______。
(2)往固体1中加碳酸钠溶液,发生反应的化学方程式为_______________。
(3)操作2为______________、洗涤、干燥。
(4)制备钼酸钠晶体还可通过向精制的MoS2中直接加入次氯酸钠溶液与氢氧化钠溶液进行氧化的方法,若氧化过程中还有硫酸钠生成,则反应的离子方程式为___________。
(5)已知钼酸钠溶液中c(MoO42-)=0.40mol/L,由钼酸钠溶液制备钼酸钠晶体时,需加入Ba(OH)2固体以除去CO32-,当BaMoO4开始沉淀时,溶液中c(CO32-)=_________[已知:Ksp(BaCO3)=2.6×10-9,Ksp(Ba MoO4)=4.0×10-8。忽略溶液的体积变化]。
(6)锂和二硫化钼形成的二次电池的总反应为xLi+nMoS2![]() Lix(MoS2)n[Lix(MoS2)n附着在电极上],则电池充电时阳极的电极反应式为____。
Lix(MoS2)n[Lix(MoS2)n附着在电极上],则电池充电时阳极的电极反应式为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢化铵(NH4H)与氯化铵结构相似。已知NH4H与水反应有氢气产生,则下列叙述不正确的是
A.NH4H的电子式是:
B.NH4H固体投入少量水中,有两种气体产生
C.NH4H中的H-离子半径比锂离子半径大
D.NH4H溶于水后,形成的溶液呈酸性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NH3可用于制氮肥![]() 尿素、碳铵等
尿素、碳铵等![]() 、HNO3、铵盐、纯碱,还可用于制合成纤维、塑料、染料等。回答下列问题:
、HNO3、铵盐、纯碱,还可用于制合成纤维、塑料、染料等。回答下列问题:
(1)传统的联氨(N2H4)合成方法是用NaClO溶液氧化NH3得到,反应的化学方程式为________________。联氨的电子式为________________。
(2)已知①N2(g)+3H2(g)2NH3(g) H=-92.4kJ/mol,②N2H4(l)+O2(g)N2(g)+2H2O(l) H=-624kJ/mol,则反应2NH3(g) +2H2O(l)N2H4(l)+O2(g) +3H2(g)的H=________,该反应的平衡常数表达式为________________,在常温下该反应________(填“能”或“不能”)自发进行。为了提高N2H4的产率,下列措施可行的是____________________。
A.增加H2O(l)的量B.增大压强C.降低温度 D.及时导出O2
(3)现在采用电解法合成氨,在电解法合成氨的过程中,用石墨作电极,阳极通入________________,阴极通入________________,阴极的电极反应式为________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com