
【题目】XeO3是一种不稳定的物质,具有强氧化性.
(1)配平反应的离子方程式:
XeO3+Mn2++H2O→MnO4﹣+Xe↑+H+
(2)反应现象为:①有气泡产生;② .
(3)被氧化的元素是 .
(4)将适量的XeO3投入30mL 0.1molL﹣1 Mn2+的水溶液中,刚好完全反应.
①此时转移电子总数为 .
②将反应后的溶液稀释至90mL,所得溶液的pH= .
【答案】
(1)5;6;9;6;5;18
(2)溶液显紫红色
(3)Mn
(4)0.015mol;1
【解析】解:(1)反应中Xe元素化合价由XeO3+6价降低为Xe中0价,总共降低6价,Mn元素化合价由Mn2+中+2价升高为MnO4﹣中+7价,总共升高5价,化合价最小公倍数为30,故XeO3系数为5,故Mn2+系数为6,再结合原子守恒配平后方程式为5XeO3+6Mn2++9H2O=6MnO4﹣+5Xe↑+18H+ , 所以答案是:5;6;9;6;5;18;(2)反应中Mn2+转化为MnO4﹣ , 溶液显紫红色,所以答案是:溶液显紫红色;(3)还原剂被氧化,反应中Mn元素化合价由Mn2+中+2价升高为MnO4﹣中+7价被氧化,所以答案是:Mn;(4)①n(Mn2+)=0.03L×0.1molL﹣1=0.003mol,反应中Mn元素化合价由Mn2+中+2价升高为MnO4﹣中+7价,转移电子物质的量为5n(Mn2+)=5×0.003mol=0.015mol,所以答案是:0.015mol;
②由两方程式可知n(H+)=3n(Mn2+)=3×0.003mol=0.009mol,溶液稀释至90mL后,溶液中c(H+)= ![]() =0.1mol/L,故溶液的pH=﹣logc(H+)=﹣log0.1=1,所以答案是:1.
=0.1mol/L,故溶液的pH=﹣logc(H+)=﹣log0.1=1,所以答案是:1.


科目:高中化学 来源: 题型:
【题目】单斜硫和正交硫转化为二氧化硫的能量变化如图所示,下列说法不正确的是( ) 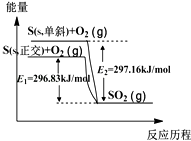
A.单斜硫和正交硫互为同素异形体
B.正交硫比单斜硫稳定
C.相同物质的量的正交硫比单斜硫所含有的能量高
D.由单斜硫制取正交硫是一个放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“封管实验”具有简易、方便、节约、绿色等优点,观察下面四个“封管实验”(夹持装置未画出),判断下列说法正确的是( ) 
A.加热时,①上部汇聚了固体碘,说明碘的热稳定性较差
B.加热时,②、③中的溶液均变红,冷却后又都变为无色
C.④中,浸泡在热水中的容器内气体颜色变深,浸泡在冰水中的容器内气体颜色变浅
D.四个“封管实验”中都有可逆反应发生
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列不属于配合物的是
A.[Cu(H2O)4]SO4·H2OB.[Ag(NH3)2]OH
C.KAl(SO4)2·12H2OD.Na[AlF6]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向NaI和NaBr的混合溶液中通入足量的氯气,充分反应后将溶液蒸干,灼烧上述残留物,最后得到的物质是
A. NaCl、I2 B. NaCl、NaBr C. NaBr、I2 D. NaCl
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com