
【题目】蛋白质发生的下列过程中,可逆的是
A. 盐析 B. 变性 C. 煮熟 D. 加入浓硫酸
 小题狂做系列答案
小题狂做系列答案科目:高中化学 来源: 题型:
【题目】FeCl3在现代工业生产中应用广泛。经查阅资料得知:无水FeCl3在空气中易潮解,加热易升华。工业上,向500—600℃的铁屑中通入氯气可生产无水氯化铁;向炽热铁屑中通入氯化氢可以生产无水氯化亚铁。
某化学研究性学习小组模拟工业生产流程制备无水FeCl3并对产物做了如下探究实验,请回答下列问题:
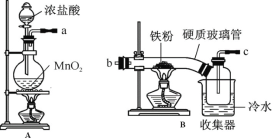
(1)装置的连接顺序为 (用a 、b、c…h表示)。
(2)i.A装置中反应的化学方程式为 。
ii.D中碱石灰的作用是 。
(3)反应结束后,生成的烟状FeCl3大部分进入收集器,少量沉积在反应管B中硬质玻璃管的右端。要使沉积得FeCl3进入收集器,需进行的操作是 。
(4)FeCl3溶液常用于吸收有毒气体H2S。反应的离子方程式为 。
(5)反应一段时间后熄灭酒精灯,冷却后将硬质玻璃管及收集器中的物质一并快速转移至锥形瓶中,加入过量的稀盐酸和少许植物油(过程中不振荡),充分反应后,进行如下实验:

淡黄色溶液中加入试剂X生成淡红色溶液的离子方程式为 。
(6)已知红色褪去的同时有气体生成,经检验为O2。该小组同学对红色褪去的原因进行探究。
①取褪色后溶液三份,第一份滴加FeCl3溶液无明显变化;第二份滴加试剂X,溶液出现红色;第三份滴加稀盐酸和BaCl2溶液,产生白色沉淀。
②另取同物质的量浓度的 FeCl3溶液滴加2滴试剂X,溶液变红,再通入O2,无明显变化。
根据上述实验得出溶液褪色的原因是: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸钠是重要食品添加剂。某化学兴趣小组以碳和浓硝酸为起始原料,设计如下装置利用一氧化氮与过氧化钠反应制备亚硝酸钠。(夹持装置和A中加热装置已略,气密性已检验)查阅资料:①HNO2为弱酸,室温下存在反应:3HNO2=HNO3+2NO↑+H2O;
②NO不与碱反应,可被酸性KMnO4溶液氧化为硝酸。
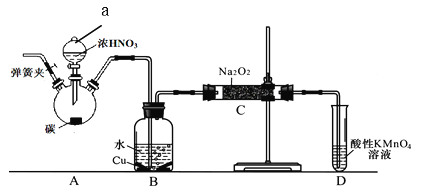
实验操作:
①关闭弹簧夹,打开A中分液漏斗活塞,滴加一定量浓硝酸,加热;
②一段时间后停止加热;
③从C中取少量固体,检验是否是亚硝酸钠。
回答下列问题:
(1)装置中仪器a的名称为 ,A中反应的化学方程式是 ;
(2)D装置的作用是 ;
(3)C中反应生成NaNO2的化学方程式是 ;
(4)检验C中产物有亚硝酸钠的正确操作是 (填序号) ;
a.取少量生成物溶于稀硫酸,若产生无色气体并在液体上方变为红棕色,则含有NaNO2
b.取少量生成物溶于水充分振荡,滴加酚酞试液,若溶液变红,则含有NaNO2
(5)经检验C的产物中亚硝酸钠含量较少。
①甲同学认为C中产物不仅有亚硝酸钠,还可能有其它固体物质。为排除干扰,甲在B、C装置间增加装置E,E中盛放的试剂应是 (写名称);
②乙同学认为除上述干扰因素外,还会有空气参与反应导致产品不纯,所以在实验操作①前应增加一步操作,该操作是 ;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请根据所学知识回答下列问题:
(1)同温同压下,反应H2(g)+Cl2(g)===2HCl(g)在光照和点燃条件下的ΔH(化学计量数相同)分别为ΔH1、ΔH2,ΔH1____________ΔH2(填“>”“<”或“=”下同)。
(2)相同条件下,2 mol氢原子所具有的能量____________1 mol 氢分子所具有的能量。
(3)已知:常温下,0.01 mol·L-1 MOH溶液的pH为10,MOH(aq)与H2SO4(aq)反应生成1 mol可溶正盐的ΔH=-24.2 kJ·mol-1,强酸与强碱的稀溶液的中和热为ΔH=-57.3 kJ·mol-1。则MOH在水溶液中电离的ΔH为_______________
(4)土壤中的微生物可将大气中H2S经两步反应氧化成SO42-,两步反应的能量变化示意图如下:
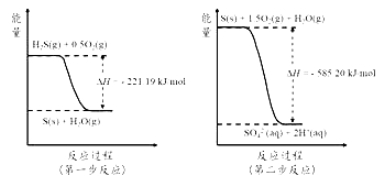
1mol H2S(g)全部氧化成SO42-(aq)的热化学方程式为______________________。
(5)一定条件,在水溶液中1 mol Cl-、ClO x-(x=1,2,3,4)的能量(KJ)相对大小如图所示。
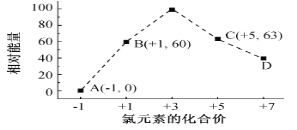
①D是______________________ (填离子符号)。
②B→A+C反应的热化学方程式为______________________ (用离子符号表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家们欲寻找一种新型的半导体材料,可以在元素周期表的( )
A.任意位置寻找
B.稀有气体元素中寻找
C.金属和非金属的分界线处寻找
D.活泼金属和活泼非金属区中寻找
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱性锌锰电池获得了广泛的使用,根据电池的电极反应,下列判断正确的是
A. Zn为负极,MnO2为正极。
B. Zn为正极,MnO2为负极。
C. 工作时电子由MnO2经外电路流向Zn极。
D. Zn电极发生还原反应,MnO2电极发生氧化反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(12分)I.甲、乙、丙、丁、戊分别是Na2SO4、Ba(NO3)2、HNO3、BaCl2、NaOH五种溶液中的一种,现利用X(一种钠盐)溶液鉴别它们,已知气体B的密度在同温同压下是氢气密度的22倍。试根据下图中的转化关系回答问题:
(1)下列物质的化学式分别为:甲____________、丙_____________、丁__________;
(2)戊的电子式为________________________;
(3)写出白色沉淀A与乙反应的离子方程式为__________________________。
II.已知:工业制备二甲醚的催化反应室中进行下列反应
CO(g)+2H2(g)![]() CH3OH(g)△H=-90.7kJ/mol①
CH3OH(g)△H=-90.7kJ/mol①
2CH3OH(g)![]() CH3OCH3(g)+H2O(g)△H=-23.5kJ/mol②
CH3OCH3(g)+H2O(g)△H=-23.5kJ/mol②
CO(g)+H2O(g)![]() CO2(g)+H2(g)△H=-41.2kJ/mol③
CO2(g)+H2(g)△H=-41.2kJ/mol③
催化反应室中总反应3CO(g)+3H2(g)![]() CH3OCH3(g)+CO2(g)的△H= _____________。
CH3OCH3(g)+CO2(g)的△H= _____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关原电池的说法中不正确的是( )
A.在内电路中,电子由正极流向负极
B.原电池的正、负极材料不一定都参与反应
C.原电池工作时,正极上发生还原反应
D.原电池工作时,可能会伴随着热能变化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com