
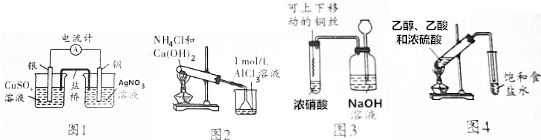
| A. | 用图1所示装置可将化学能转化为电能 | |
| B. | 用图2所示装置烧杯中先出现白色沉淀,后溶解 | |
| C. | 用图3所示装置进行铜与浓硝酸反应的实验 | |
| D. | 用图4所示装置制取乙酸乙酯 |
分析 A.含有盐桥的原电池中,电极材料与其对应的电解质具有相同的金属元素;
B.Al(OH)3能溶于强碱溶液但不能溶于弱碱溶液;
C.浓硝酸和铜反应生成二氧化氮,用氢氧化钠溶液吸收;
D.饱和食盐水不能和乙酸反应.
解答 解:A.含有盐桥的原电池中,电极材料与其对应的电解质具有相同的金属元素,即该装置中Cu、Ag互换才能构成原电池,故A错误;
B.加热条件下,氯化铵和氢氧化钙反应生成气体,氨气溶于水生成一水合氨,一水合氨和氯化铝反应生成氢氧化铝,Al(OH)3能溶于强碱溶液但不能溶于弱碱氨水溶液,所以烧杯中出现白色沉淀,但白色沉淀不溶解,故B错误;
C.浓硝酸和铜反应生成二氧化氮,二氧化氮有毒能污染空气,可用氢氧化钠溶液吸收,防止污染空气,故C正确;
D.饱和食盐水不能和乙酸反应,但饱和碳酸钠溶液能和乙酸反应生成可溶性的乙酸钠,能溶解乙醇,且能抑制乙酸乙酯溶解性,应该用饱和碳酸钠溶液,故D错误;
故选C.
点评 本题考查化学实验方案评价,为高频考点,涉及物质制备、原电池原理、基本实验操作等知识点,侧重于学生的分析能力和实验能力的考查,明确实验原理及物质性质是解本题关键,注意氢氧化铝的两性,为易错点.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
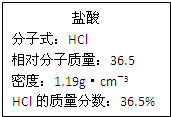 如图为实验室某浓盐酸试剂瓶上的标签,试根据有关数据回答下列问题:
如图为实验室某浓盐酸试剂瓶上的标签,试根据有关数据回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 锥形瓶用蒸馏水洗涤后,再用氢氧化钠溶液润洗 | |
| B. | 滴定管用蒸馏水洗涤后,即装入标准盐酸进行滴定 | |
| C. | 滴定时,边摇动锥形瓶边观察瓶中溶液的颜色变化 | |
| D. | 当滴定至溶液由黄色变为橙色时,即为滴定终点 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯元素的化合价升高 | B. | Fe(NO3)3是氧化剂 | ||
| C. | 铁元素被氧化 | D. | NaOH发生氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 7种 | B. | 9种 | C. | 13种 | D. | 15种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 升高温度和增大压强 | B. | 降低温度和减小压强 | ||
| C. | 降低温度和增大压强 | D. | 升高温度和减小压强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com