
| A. | CO2通入澄清石灰水中 | B. | 稀硝酸中加入铜片 | ||
| C. | 稀硝酸中加入铁屑 | D. | HCl溶液滴入Na2CO3溶液中 |
分析 A.少量二氧化碳与氢氧化钙反应生成碳酸钙沉淀,过量二氧化碳与氢氧化钙反应生成碳酸氢钙;
B.稀硝酸和铜反应只能生成硝酸铜、一氧化氮和水;
C.铁与稀硝酸反应生成一氧化氮,铁的量不同,得到产物不同;
D.Na2CO3和HCl的相对量的不同可生成NaHCO3或CO2,滴加少量盐酸,生成碳酸氢钠,过量盐酸生成二氧化碳气体.
解答 解:A.CO2通入石灰水,CO2过量则生成碳酸氢钙,2CO2+Ca(OH)2═Ca(HCO3)2,氢氧化钙过量则生成碳酸钙,Ca(OH)2+CO2═CaCO3↓+H2O,反应物用量不同,产物不同,故A不选;
B.稀硝酸和铜反应只能生成硝酸铜、一氧化氮和水,3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O和物质的用量无关,故B选;
C.铁和稀硝酸反应有两种情况:若铁过量,铁和稀硝酸反应生成硝酸亚铁,3Fe+8HNO3=3Fe(NO3)2+2NO↑+4H2O,若稀硝酸过量,铁和稀硝酸反应生成硝酸铁,Fe+4HNO3=Fe(NO3)3+NO2↑+2H2O,所以铁和硝酸的反应与硝酸的浓度、铁的用量有关,故C不选;
D.HCl溶液滴入Na2CO3溶液中,HCl量少生成碳酸氢钠,Na2CO3+HCl=NaHCO3,HCl量多生成二氧化碳,Na2CO3+2HCl=2NaCl+CO2↑+H2O,和用量有关,故D不选;
故选D.
点评 本题考查了物质的用量或浓度不同导致产物不同,明确物质之间的反应是解本题的关键,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
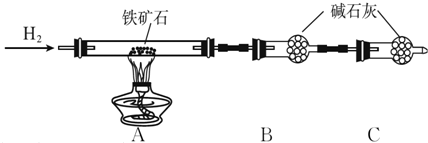
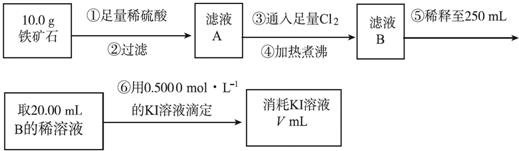
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
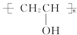 $\stackrel{H+}{→}$
$\stackrel{H+}{→}$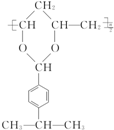
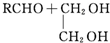 $\stackrel{H+}{→}$
$\stackrel{H+}{→}$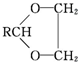 +H2O
+H2O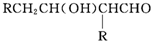 $→_{-H_{2}O}^{△}$
$→_{-H_{2}O}^{△}$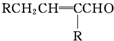
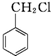 $\stackrel{K_{2}Cr_{2}O_{7}-KOH}{→}$
$\stackrel{K_{2}Cr_{2}O_{7}-KOH}{→}$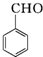
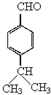 ,E中含有的官能团名称为羟基、醛基.
,E中含有的官能团名称为羟基、醛基.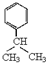 .
.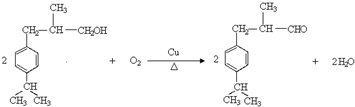 .
. .
.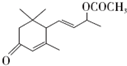 是否互为同分异构体否(填“是”或“否”),符合下列条件的
是否互为同分异构体否(填“是”或“否”),符合下列条件的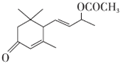 的同分异构体有2种,写出其中一种的结构简式
的同分异构体有2种,写出其中一种的结构简式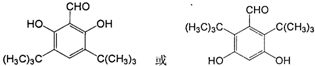 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 式量为30的碳、氢、氧组成的化合物无同分异构体 | |
| B. | 式量为128的烃的分子式不一定是C9H20 | |
| C. | 烃的式量可以是偶数,也可以是奇数 | |
| D. | 有机物分子中,H原子数可以是偶数,也可以是奇数 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
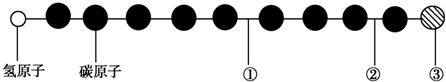
| A. | 该物质是烃的含氧衍生物 | B. | ①处的化学键是碳碳双键 | ||
| C. | ②处的化学键是碳碳单键 | D. | ③处的原子可能是氯原子或氟原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
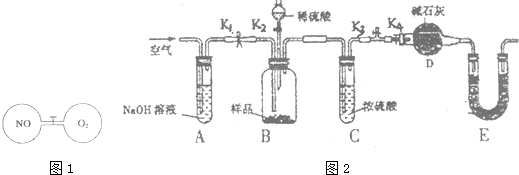
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.1mol/L | B. | 1.5mol/L | C. | 1.2mol/L | D. | 1.0mol/L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com