
| A元素的核外电子数和电子层数相等 |
| B元素原子的核外p电子数比s电子数少1 |
| C原子的第一至第四电离能如下: I1=738kJ•mol-1 I2=1451kJ•mol-1 I3=7733kJ•mol-1 I4=10540kJ•mol-1 |
| D原子价电子层的p轨道半满 |
| E元素的主族序数与周期数的差为4 |
| F是前四周期中电负性最小的元素 |
| G在周期表的第七列 |
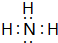 .
.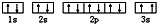 ,该同学所画的电子排布图违背了泡利原理.
,该同学所画的电子排布图违背了泡利原理.分析 A、B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大.A元素的核外电子数和电子层数相等,则A为H元素;B元素原子的核外p电子数比s电子数少1,原子核外电子排布为1s22s22p3,故B为N元素;由C原子的第一至第四电离能数据可知,第三电离能剧增,故C表现+2价,处于ⅡA族,原子序数大于N元素,故C为Mg元素;D处于第三周期,D原子价电子层的p轨道半满,价电子排布式为3s23p3,故D为P元素;E也处于第三周期,E元素的主族序数与周期数的差为4,E处于第ⅦA族,故E为Cl元素;F是前四周期中电负性最小的元素,F为第四周期元素,故F为K元素;G在第四周期周期表的第7列,G为Mn元素.
解答 解:A、B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大.A元素的核外电子数和电子层数相等,则A为H元素;B元素原子的核外p电子数比s电子数少1,原子核外电子排布为1s22s22p3,故B为N元素;由C原子的第一至第四电离能数据可知,第三电离能剧增,故C表现+2价,处于ⅡA族,原子序数大于N元素,故C为Mg元素;D处于第三周期,D原子价电子层的p轨道半满,价电子排布式为3s23p3,故D为P元素;E也处于第三周期,E元素的主族序数与周期数的差为4,E处于第ⅦA族,故E为Cl元素;F是前四周期中电负性最小的元素,F为第四周期元素,故F为K元素;G在第四周期周期表的第7列,G为Mn元素.
(1)NH3的电子式: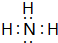 ,故答案为:
,故答案为: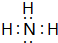 ;
;
(2)B为N元素,核外电子排布式为1s22s22p3,基态原子中能量最高的电子处于2p能级,有3个电子,其电子云在空间有3个方向,原子轨道呈哑铃形,
故答案为:3;哑铃;
(3)某同学根据上述信息,推断C基态原子的核外电子排布为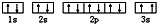 ,该同学所画的电子排布图中3s能级中2个电子自旋方向相同,违背了泡利原理,
,该同学所画的电子排布图中3s能级中2个电子自旋方向相同,违背了泡利原理,
故答案为:泡利原理;
(4)同周期自上而下电负性减小,故电负性N>P,故答案为:N>P;
(5)G为Mn元素,是25号元素,位于第四周期第ⅦB族,最后填充的为d电子,为d区元素,核外电子排布式为1s22s22p63s23p63d54s2,
故答案为:ⅦB;d;1s22s22p63s23p63d54s2;
(6)检验K元素的方法是焰色反应,产生此现象的原因:当基态原子的电子吸收能量后,电子会跃迁到较高能级,变成激发态原子.电子从较高能量的激发态跃迁到较低能量的激发态或基态时,将以光的形式释放能量,
故答案为:焰色反应;当基态原子的电子吸收能量后,电子会跃迁到较高能级,变成激发态原子.电子从较高能量的激发态跃迁到较低能量的激发态或基态时,将以光的形式释放能量.
点评 本题是对物质结构与性质的考查,涉及结构性质与位置关系、核外电子排布规律、电负性、电离能、电子跃迁等,题目比较综合,难度中等,推断元素是解题的关键,注意基础知识的掌握.


科目:高中化学 来源: 题型:选择题
| A. | 氢氧化钠溶于水只发生扩散作用 | |
| B. | 氢氧化钠溶于水只发生水合作用 | |
| C. | 氢氧化钠溶于水扩散过程吸收热量大于水合过程放出的热量 | |
| D. | 氢氧化钠溶于水扩散过程吸收热量小于水合过程放出的热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
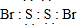 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3:7 | B. | 3:4 | C. | 4:7 | D. | 1:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 外观澄清、稳定 | B. | 分散质粒子直径为1---100nm | ||
| C. | 分散至粒子能透过半透膜 | D. | 丁达尔现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 25℃时18 g水 | |
| B. | 标准状况下含6.02×1023个原子的Cl2 | |
| C. | 标准状况下1 mol氨气 | |
| D. | 常温常压下44 g二氧化碳 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4个 | B. | 5个 | C. | 8个 | D. | 12个 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅤⅡA | 0 |
| 2 | C | N | O | |||||
| 3 | Na | Mg | Si | S | Cl | Ar | ||
| 4 | Ca |
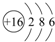 ;其最外层共有6种不同运动状态的电子;
;其最外层共有6种不同运动状态的电子;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com