
I����A��B��C��D��E���ֶ���������Ԫ�أ����ǵ�ԭ��������������AԪ�ص�ԭ���ǰ뾶��С��ԭ�ӣ�BԪ�ص�����������ˮ���������⻯�ﷴӦ����һ����X��D��Aͬ�壬����Eͬ���ڣ�EԪ�ص������������Ǵ�����������3/4����A��B��D��E������Ԫ�أ�ÿһ�ֶ�����CԪ���γ�ԭ�Ӹ����Ȳ���ͬ�Ķ��ֻ�����ش��������⣺
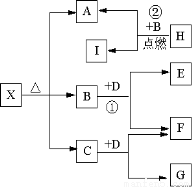
��1��д����ӦԪ�����ƣ� C_________
��2��������ס��Ҿ�����A��C��D��E����Ԫ����ɵ���ѧ�����Ļ�������������ᷴӦ��������NaOH��Һ��Ӧ������Һ������Һ��Ӧ�����ӷ���ʽΪ��_____________________������C��D��E����Ԫ����ɣ�ԭ�Ӹ�����Ϊ3��2��2��������Һ�ͱ���Һ��Ӧ�����ӷ���ʽΪ��_________________��
��3��N2H4�ĵ���ʽΪ ����N2H4��O2ͨ�뵽��A��C��D����Ԫ��������ʵ�ϡ��Һ�й���ԭ��أ����ĵ缫��ӦʽΪ ��
�� ��֪X��һ���Σ�H�dz����������ʣ�F��I�dz����ǽ������ʣ�E��G���ǹ�ҵ����Ҫ�ļ������ʣ���������ͼ��ʾ�Ĺ�ϵ��
�Իش���������
��1��G�к��еĻ�ѧ�������У� ��
��2��д���ڷ�Ӧ�Ļ�ѧ����ʽ ����˫���ŷ���ʾ�÷�Ӧ����ת�Ƶķ������Ŀ ��

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2016��㶫ʡ�����и�����ѧ�ڵڶ��ε��в��Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
�����£�������������Һ��
�� | �� | �� | �� |
0.1mol/L NaOH��Һ | pH = 11 NaOH��Һ | 0.1mol/L CH3COOH��Һ | pH = 3 CH3COOH��Һ |
����˵����ȷ����
A����ˮ�����H+��Ũ��c(H+) ���٣���
B�����ܼ�����ˮϡ����ԭ����100��ʱ��������Һ��pH=5
C������ۻ�ϣ�����ҺpH = 7�������V(NaOH)��V(CH3COOH)
D��������ܵ������ϣ�����ҺpH < 7��������Ũ�ȵĹ�ϵΪ��c(CH3COO-) + c(OH-) = c(Na+) +c(H+)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016�켪��ʡ������ѧ�ڵڶ���ģ�⻯ѧ�Ծ��������棩 ���ͣ�ѡ����
��A��B��C��D���ֶ�����Ԫ�������ڱ���λ����ͼ��ʾ����֪��A2+��Cԭ�ӵĵ��������2�������ƶϲ���ȷ����
���� | C | |||
A | B | ���� | D |
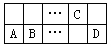
A��A��D��ɵĻ����������������ˮ��Һ������
B����Aͬ��������Cͬ�����EԪ�أ�������������Ӧˮ������ijЩ��ѧ��Ӧ�г�������
C�����Ӱ뾶��C��A��B
D��B��C�γɵĻ�������ұ��ҵ��һ��ԭ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016�콭��ʡ�Ͼ�����У������ѧ��12��������ѧ�Ծ��������棩 ���ͣ�ʵ����
��ҵ�����÷���м�����������������������ȣ�������ʽ������[Fe(OH)SO4]�Ĺ����������£�
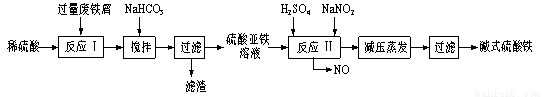
��֪������������������������ʽ����ʱ��Һ��pH���±���
������ | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
��ʼ���� | 2.3 | 7.5 | 3.4 |
��ȫ���� | 3.2 | 9.7 | 4.4 |
�ش��������⣺
��1����������NaHCO3��Ŀ���� ���ù����С����衱�������� ��
��2����Ӧ���е����ӷ���ʽΪ ����ʵ�������У���Ӧ��ͬʱͨ��O2�Լ���NaNO2��������O2�������� �����û�ѧ����ʽ��ʾ��
��3�������м�ʽ��������Һ����ʱ��Ҫ�ڼ�ѹ�����µ�ԭ���� ��
��4����ҽҩ�ϳ����������������ᡢ����Ļ��Һ��Ӧ�Ʊ���ʽ�������������ҹ�����������Ʒ�в��ú���Fe2+��NO3-��Ϊ�������ò�Ʒ���Ƿ���Fe2+��Ӧʹ�õ��Լ�Ϊ ��(��д��ĸ)
A����ˮ B��KSCN��Һ C��NaOH��Һ D������KMnO4��Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016�콭��ʡ������ѧ�ڵ������¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
ijģ�⡰�˹���Ҷ���绯ѧʵ��װ������ͼ��ʾ����װ���ܽ�H2O��CO2ת�� ΪO2��ȼ��(C3H8O)������˵����ȷ����
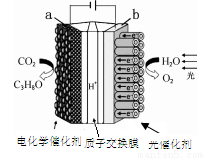
A����װ�ý���ѧ��ת��Ϊ���ܺ͵���
B����װ�ù���ʱ��H����b������a����Ǩ��
C��ÿ����1molO2,��44gCO2����ԭ
D��a�缫�ķ�ӦΪ:3CO2+18H��-18e��=C3H8O+5H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016���Ϻ���ʮ��У������ѧ�ڵ�һ��������ѧ�Ծ��������棩 ���ͣ������
��Ԫ������Ȼ���д��ڶ��ּ�̬�������ɻش��������⣺
23����Ԫ��ԭ�Ӻ����� ��δ�ɶԵ��ӣ�������� ��������ͬ�ĵ��ӡ�
24����������ͬ����Ԫ�أ�������˵�����߷ǽ��������ǿ������ (����)��
a��NH3��PH3�ȶ���ǿ
b��������������ֱ�ӻ��ϣ�������������ֱ�ӻ���
c��������ǿ�����ԣ������ǿ������
d���������������壬�����ǹ���
25����֪���Ȱ�NH2Cl�۵�-66�棬NH4Cl�۵�340�棬�Ȱ��ĵ���ʽΪ �������ʽṹ�ĽǶȽ��������۵����ϴ��ԭ�� ��
26��NH2Cl��HClO�ȶ��Ըߣ���ˮ�⣬��ˮ����ܲ�����ɱ�����������ʶ���Ϊ����ˮ�Ļ�����������NH2Cl����ˮ��Ļ�ѧ����ʽΪ ��
27����ҵ���������۳�ȥ������ˮ�е�NO3������������ҺpH��10.7����ʱ����Ӧ����������AlO2���������Ͱ������������Ͱ����������Ϊ4 : 1����ԭ���������������ʵ���֮��Ϊ ���������Ͱ����������Ϊ1 : 1�����ȥ0.1mol NO3����������______g��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016���Ĵ�ʡ������ѧ��12���¿����ۻ�ѧ�Ծ��������棩 ���ͣ������
��.��1����ҵ�Ϻϳɰ��ķ�Ӧ��N2(g)��3H2(g) 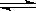 2NH3(g) ��H����92.60 kJ��mol��1��
2NH3(g) ��H����92.60 kJ��mol��1��
�ٺ����ݻ��̶����ܱ������з�����Ӧ��N2(g)��3H2(g) 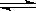 2NH3(g)������˵����˵��������Ӧ�ﵽƽ��״̬����____________��
2NH3(g)������˵����˵��������Ӧ�ﵽƽ��״̬����____________��
a.��λʱ��������2n mol NH3��ͬʱ����3n mol H2
b.��λʱ��������6n mol N��H����ͬʱ����2n mol H��H��
c.��N2��H2��NH3�����ʵ���Ũ�ȱ仯��ʾ�ķ�Ӧ����֮��Ϊ1��3��2
d.��������ƽ��Ħ����������
e.�����ڵ������ܶȲ���
f.�����������ѹǿ����
��2����֪�ϳɰ���Ӧ��ij�¶���2 L���ܱ������н��У�����������ݣ�
���ʵ���(mol) | 0 | 1 | 2 | 3 | 4 |
N2 | 1.50 | n1 | 1.20 | n3 | 1.00 |
H2 | 4.50 | 4.20 | 3.60 | n4 | 3.00 |
NH3 | 0 | 0.20 | n2 | 1.00 | 1.00 |
���ݱ������ݼ��㣺
�ٷ�Ӧ���е�2 hʱ�ų�������Ϊ________ kJ��
��0��1 h��N2��ƽ����Ӧ����Ϊ________ mol��L��1��h��1��
�۴��¶��¸÷�Ӧ�Ļ�ѧƽ�ⳣ��K��________(������λС��)��
�ܷ�Ӧ�ﵽƽ�������ƽ����ϵ���ټ���N2��H2��NH3��1.00 mol����ѧƽ�⽫��________�����ƶ�(�����Ӧ�����淴Ӧ��)��
��.��1��������̼��һ����Ҫ���������壬���ٶ�����̼���ŷ��ǽ������ЧӦ����Ч;����Ŀǰ���ɶ�����̼�ϳɶ����ѵ��о�������ȡ�����ش��չ���仯ѧ��Ӧ����ʽΪ2CO2(g)��6H2(g) 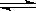 CH3OCH3(g)��3H2O(g) ��H��0�������������ȼ����Ϊ1 455 kJ��mol��1����ҵ���úϳ���(CO��H2)ֱ�ӻ��Ӻϳɶ����ѡ������й�������ȷ����________��
CH3OCH3(g)��3H2O(g) ��H��0�������������ȼ����Ϊ1 455 kJ��mol��1����ҵ���úϳ���(CO��H2)ֱ�ӻ��Ӻϳɶ����ѡ������й�������ȷ����________��
A�������ѷ����к����Թ��ۼ�
B����������Ϊ����ȼ�ϲ��������Ⱦ��
C���������ǷǼ��Է��� D����ʾ������ȼ���ȵ��Ȼ�ѧ����ʽΪCH3OCH3(g)��3O2(g)===2CO2(g)��3H2O(g) ��H����1 455 kJ��mol��1
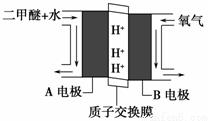
��2����ɫ��Դ��ֱ�Ӷ�����ȼ�ϵ�ء��Ĺ���ԭ��ʾ��ͼ��ͼ��ʾ������Ϊ________(�A�缫����B�缫��)��H+�ƶ�����Ϊ���� �� (��A��B)��д��A�缫�ĵ缫��Ӧʽ��___________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ�갲��ʡ�߶���ѧ�ڵ������¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
������ij��Һ�У���ˮ�������c(H+)Ϊ1��10��12mol/L������Һ��һ���ܴ����������������
A��K+��Na+��SO42����NO3�� B��Na+��K+��ClO����CO32��
C��Fe2+��Mg2+��Cl����SO42�� D��NH4+��Cl����K+��SO32��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016�����ʡ����ˮһ�и�����ѧ��������ѧ�Ծ��������棩 ���ͣ�ѡ����
������ʵ������ƽ���ƶ�ԭ�������͵��ǣ� ��
A����ơ��ƿ�ǣ�������������
B��ϡ��CH3COOHʱ����Һ��CH3COO����Ŀ����
C����ҵ�ϳɰ�����500�����ҵ��¶�
D���ȵĴ�����Һ��ȥ��Ч������ĺ�
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com