
| A、c(NH4+)>c(Cl-) |
| B、c(NH4+)<c(Cl-) |
| C、c(NH4+)=c(Cl-) |
| D、不能确定c(NH4+)与c(Cl-)的大小 |
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
| A、若pH=7,HA的浓度一定为0.1 mol?L-1 |
| B、若pH=7,A-的浓度可能小于Na+的浓度 |
| C、若pH<7,溶液中的微粒浓度关系为[Na+]=[HA]+[A-] |
| D、若pH=12,且HA为强酸时,HA的浓度应为0.08 m01.L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、使甲基橙呈红色的溶液中:Na+、AlO2-、NO3-、CO32- |
| B、c(ClO-)=1.0 mol?L-1溶液:Na+、SO32-、S2-、Cl- |
| C、含有0.1 mol?L-1 HCO3-的溶液:Na+、Fe3+、NO3-、C6H5O- |
| D、c(OH-)=0.1 mol?L-1的溶液:Na+、K+、CO32-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| 充电 |
| A、放电时,正、负极附近溶液pH不变 |
| B、放电时正极材料为MH,发生氧化反应 |
| C、充电时阳极反应:Ni(OH)2+OH--e-=NiOOH+H2O |
| D、放电时,每转移1mol电子,负极有1 mol NiOOH被还原 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、 可用于分离苯和硝基苯的混合物 |
B、 可用于吸收HCl气体.并防止倒吸 |
C、 可用于以NH4Cl为原料,实验室制取NH3 |
D、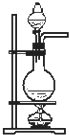 可用于实验室制取乙烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ③ | ④ | ||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ | (11) | (12) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com