
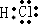 ��X2Y�Ľṹʽ
��X2Y�Ľṹʽ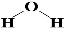 ��
��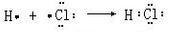 ��
������ X�ĵ��ʿ�����Z�ĵ�����ȼ������XZ������Ϊ��ɫ��������������ȼ�ղ�����ɫ���棬��XZ��������ˮ����ˮ��Һ�е����X+��Z-����X��H2��Z��Cl2��������������ȼ������HCl��������ˮ����ˮ��Һ��ʹ��ɫʯ����ֽ��죻
X��Y��Z�ĵ����ڳ�����Ϊ���壬������X�ĵ��ʿ��Ժ�Y���ʻ�������������X2Y��������ΪҺ�壩����Y�ĵ�����O2��X2Y��H2O������YΪOԪ�أ������ĵ�������H2O����������ʹ����ᣬ���������Ư���ԣ�Ȼ��������ʵ��������������
��� �⣺�ĵ��ʿ�����Z�ĵ�����ȼ������XZ������Ϊ��ɫ��������������ȼ�ղ�����ɫ���棬��XZ��������ˮ����ˮ��Һ�е����X+��Z-����X��H2��Z��Cl2��������������ȼ������HCl��������ˮ����ˮ��Һ��ʹ��ɫʯ����ֽ��죻X��Y��Z�ĵ����ڳ�����Ϊ���壬������X�ĵ��ʿ��Ժ�Y���ʻ�������������X2Y��������ΪҺ�壩����Y�ĵ�����O2��X2Y��H2O������YΪOԪ�أ������ĵ�������H2O����������ʹ����ᣬ���������Ư���ԣ�
��1�����ݷ�����֪��Z��Ԫ�ط���Cl��������XZΪHCl���Ȼ���Ϊ���ۻ���������ʽΪ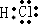 ��X2YΪˮ��ˮ�����к���2��O-H������ṹʽΪ��
��X2YΪˮ��ˮ�����к���2��O-H������ṹʽΪ��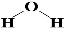 ��
��
�ʴ�Ϊ��Cl��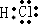 ��
��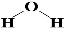 ��
��
��2��XZΪHCl��HClΪ���ۻ�����õ���ʽ��ʾ���γɹ���Ϊ��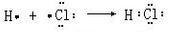 ��
��
�ʴ�Ϊ��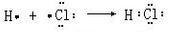 ��
��
��3��������ˮ��Ӧ�����Ȼ���ʹ����ᣬ���������Ư���ԣ���Ӧ�Ļ�ѧ����ʽΪ��Cl2+H2O=HCl+HClO��
�ʴ�Ϊ��Cl2+H2O=HCl+HClO��
��4��X2��Y2�ֱ�ΪH2��O2��H2��O2��KOH��Һһ����Թ�������ȼ�ϵ�أ��÷�Ӧ�ĵ缫�ܷ�ӦΪ��2H2+O2=2H2O��
�ʴ�Ϊ��2H2+O2=2H2O��
��5����֪��1mol H-H����1mol Cl-Cl����1mol H-Cl���ֱ���Ҫ���յ�����Ϊ436kJ��243kJ��432kJ����ӦH2��g��+Cl2��g��=2HCl��g���ġ�H=��Ӧ���ܼ���-�������ܼ���=436kJ/mol+243kJ/mol-432kJ/mol��2=-185kJ/mol��
�ʴ�Ϊ��-185��
���� ���⿼��ԭ�ӽṹ��Ԫ�������ɵĹ�ϵ����Ӧ�����ʱ��Ӧ�ã���Ŀ�Ѷ��еȣ��ƶ�Ԫ��Ϊ���ؼ���ע�����շ�Ӧ��������ܼ����뷴Ӧ��֮��Ĺ�ϵ������������ѧ�����ۺ�Ӧ��������


 ÿ��10���ӿ�����������������ϵ�д�
ÿ��10���ӿ�����������������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��ֱ��������������3��̼ԭ�Ӳ���һ��ֱ���� | |
| B�� | �ڹ����������ܹ�����������ȡ����Ӧ | |
| C�� | ����ȶ���е�� | |
| D�� | 1 mol������ȫȼ������5 mol O2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | Һ̬��������Ӽ������������Է�����ķе���Ȼ���� | |
| B�� | CH4��CO2��C2H2���Ǻ��м��Լ��ķǼ��Է��� | |
| C�� | [Cu��NH3��4]2+�к������Ӽ������Լ�����λ�� | |
| D�� | ��Ϊ���ǻ���ԭ����Ŀ���٣���������HClO4��H2SO4��H3PO4 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | K+��Na+��HCO3-��Cl- | B�� | K+��MnO4-��Br-��Cl- | ||
| C�� | Na+��Cl-��NO3-��SO42- | D�� | Al3+��NH4+��Cl-��SO42- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��������Һ��ͨ��CO2���壺SiO32-+H2O+CO2�TH2SiO3��+CO32- | |
| B�� | ����������������Һ��Ӧ��Cl2+OH-�TCl-+ClO-+2H2O | |
| C�� | �������백ˮ��Ӧ��Al3++3NH3•H2O�TAl��OH��3��+3NH4+ | |
| D�� | С�մ���Һ��ϡ���ᷴӦ��HCO3-+H+�TH2O+CO2�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
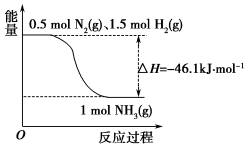 ���ڹ�ũҵ������Ӧ�ù㷺��
���ڹ�ũҵ������Ӧ�ù㷺���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
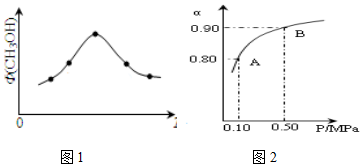 ��ѧ��Ϊʵ�֡���̼�����룬�ѿ����е�CO2ת��Ϊ��������Դ�״���CH3OH�����÷�Ӧ���Ȼ�ѧ����ʽΪ��
��ѧ��Ϊʵ�֡���̼�����룬�ѿ����е�CO2ת��Ϊ��������Դ�״���CH3OH�����÷�Ӧ���Ȼ�ѧ����ʽΪ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
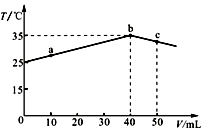
| A�� | a��b�Ĺ����У���Һ��c��A-����c��HA��֮��ʼ�ղ��� | |
| B�� | b���ʾ���ǡ����ȫ��Ӧ | |
| C�� | ��Ũ�ȵ�NaOH��NaA�����Һ��һ�����ڹ�ϵ��c��Na+����c��A-����c��H+����c��OH-�� | |
| D�� | 25��ʱ��HA�ĵ���ƽ�ⳣ��KaԼΪ1.23��10-3 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com