
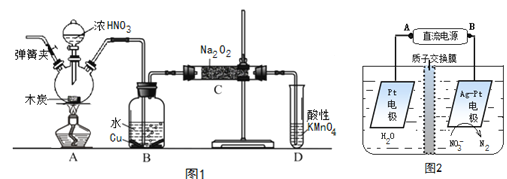
【题目】亚硝酸钠(NaNO2)是重要的防腐剂。现以木炭、浓硝酸、水和铜为原料生成的一氧化氮与过氧化钠反应制备亚硝酸钠的装置如图1所示(部分夹持装置略)。
已知:
①2NO+Na2O2→2NaNO2
②3NaNO2+3HCl→3NaCl+HNO3+2NO↑+H2O
③酸性条件下,NO或NO2-都能与MnO4-反应生成NO3-和Mn2+
回答下列问题:
(1)写出浓硝酸与木炭反应的化学方程式_____________________________________________;
(2)B中观察到的主要现象是___________________________________________________________,
D装置的作用是______________________________________________;
(3)检验C中产物有亚硝酸钠的方法是______________________________________________;
(4)经检验C产物中除亚硝酸钠外还含有副产物碳酸钠和____________,为避免产生这些副产物应在B、C装置间增加装置E,仪器E的名称是___________,E中盛放的试剂应是_________(填字母);
A.浓H2SO4B.碱石灰 C.无水CaCl2
(5)将1.56g过氧化钠完全转化成为亚硝酸钠,理论上至少需要木炭___________g 。
(6)反应后烧瓶A中仍然存在一定量的硝酸,不能直接排放,用NaOH溶液调成中性,再用电化学降解法进行处理,电化学降解NO3-的原理如上图2所示。25℃时,反应进行10min,溶液的pH由7变为12 。
电源正极为________(填A或B),阴极反应式为___________________________________________。
【答案】C+4HNO3(浓)![]() CO2↑+4NO2↑+2H2O 铜片逐渐溶解,溶液变为蓝色,有无色气体产生 吸收未反应的NO 取样,加入稀盐酸,产生无色气体,遇到空气变为红棕色 氢氧化钠 干燥管 B 0.36g A 2NO3- +6H2O +10e-=N2↑+12OH-
CO2↑+4NO2↑+2H2O 铜片逐渐溶解,溶液变为蓝色,有无色气体产生 吸收未反应的NO 取样,加入稀盐酸,产生无色气体,遇到空气变为红棕色 氢氧化钠 干燥管 B 0.36g A 2NO3- +6H2O +10e-=N2↑+12OH-
【解析】
(1)硝酸与木炭反应,硝酸做氧化剂被还原为NO2,木炭做还原剂被还原为CO2,浓硝酸与木炭反应的化学方程式 C+4HNO3(浓)![]() CO2↑+4NO2↑+2H2O,答案为:C+4HNO3(浓)
CO2↑+4NO2↑+2H2O,答案为:C+4HNO3(浓)![]() CO2↑+4NO2↑+2H2O;
CO2↑+4NO2↑+2H2O;
(2)NO2溶于水生成硝酸,硝酸和Cu反应生成NO,所以可以看到的现象为,铜牌溶解,溶液变成蓝色,有气体产生,产生的NO和Na2O2反应生成NaNO2,未反应完的NO被D中的高锰酸钾氧化,以免污染空气,答案为:铜片逐渐溶解,溶液变为蓝色,有无色气体产生; 吸收未反应的NO;
(3)3NaNO2+3HCl→3NaCl+HNO3+2NO↑+H2O,检验C中产物有亚硝酸钠的方法是取样,加入稀盐酸,产生无色气体,遇到空气变为红棕色,答案为:取样,加入稀盐酸,产生无色气体,遇到空气变为红棕色;
(4)反应过程中CO2和H2O没有出去,所以C中副产物有碳酸钠、氢氧化钠,同时除去CO2和H2O,最好选用碱石灰做干燥剂,盛装仪器为干燥管,答案为:氢氧化钠; 干燥管;B;
(5)根据2n(Na2O2)~n(NaNO2)~n(NO)~1/3n(NO2)~3n(C),所以有n(C)= 3/2n(Na2O2)=3/2×1.56g/78g/mol=0.03mol,需要C的质量为0.03mol×12g/mol=0.36g,答案为:0.36g;
(6)电解池中阳极发生氧化反应,电源B极发生的是还原反应为阴极,那么A极是阳极,阴极反应式为2NO3- +6H2O +10e-=N2↑+12OH-,答案为:A,2NO3- +6H2O +10e-=N2↑+12OH-.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】100mL 0.3mol·L-1 Na2SO4溶液和50mL 0.2mol·L-1 Al2(SO4)3溶液混合后,溶液中SO42-的物质的量浓度为(假设混合前后溶液体积变化忽略不计)( )
A.0.20mol·L-1B.0.25mol·L-1C.0.40mol·L-1D.0.50mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活密切相关,下列过程与氧化还原反应无关的是( )
A.酸性重铬酸钾用于检测酒精
B.铝粉与强碱溶液反应放热
C.植物油在空气中变质,产生“哈喇”味
D.海水经风吹日晒获得粗盐
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】东晋《华阳国志·南中志》卷四中已有关于白铜的记载,云南镍白铜(铜镍合金)闻名中外,曾主要用于造币,亦可用于制作仿银饰品。回答下列问题:
(1)镍元素基态原子的电子排布式为______,3d能级上的未成对电子数为_______。
(2)硫酸镍溶于氨水形成[Ni(NH3)6]SO4蓝色溶液。
①[Ni(NH3)6]SO4中阴离子的立体构型是________。
②在[Ni(NH3)6]SO4中Ni2+与NH3之间形成的化学键称为______,提供孤电子对的成键原子是______。
③氨的沸点_______(填“高于”或“低于”)膦(PH3),原因是_______;氨是______分子(填“极性”或“非极性”),中心原子的轨道杂化类型为_______。
(3)铜晶体铜碳原子的堆积方式如图所示。
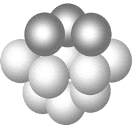
①基态铜在元素周期表中位置__________________。
②每个铜原子周围距离最近的铜原子数目_________。
(4)某M原子的外围电子排布式为3s23p5,铜与M形成化合物的晶胞如图所示(黑点代表铜原子)。
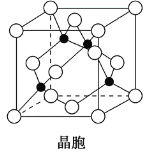
①该晶体的化学式为__________________。
②已知铜和M的电负性分别为1.9和3.0,则铜与M形成的化合物属于________(填“离子”或“共价”)化合物。
③已知该晶体的密度为ρ g·cm-3,阿伏加德罗常数为NA,则该晶体中铜原子和M原子之间的最短距离为________pm(只写计算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究小组采用电解法(惰性电极)将含有Al(OH)3、MnO2和少量Na2CrO4的浆液分离成固体混合物和含铬元素的溶液,装置如下。
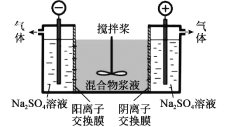
下列说法不正确的是( )
A.阳极的电极反应式为:2H2O - 4e- = O2↑+4H+
B.CrO42-通过阴离子交换膜进入阳极室,从而实现与浆液的分离
C.阴极室生成的物质可用于固体混合物Al(OH)3和MnO2的分离
D.适当增大电压,CrO42-也可在阴极室转化为Cr(OH)3除去
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁是应用最广泛的金属,自远古时代人类就学会了炼铁,到目前为止,人类研制出了很多炼铁的方法。某研究性学习小组同学在实验室中模拟工业炼铁的过程,实验装置如下:

(1)写出得到单质铁的化学方程式:_________________________。
(2)实验过程中看到玻璃管内的粉末由红棕色逐渐变黑,请设计一个实验来验证生成了单质铁:______。
(3)装置末端气球的作用为_____________________________。实验结束时,应该先停止加热还是先停止通入CO?原因是什么?_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组以电路板刻蚀液(含有大量Cu2+、Fe2+、Fe3+)为原料制备纳米Cu20,制备流程如下:
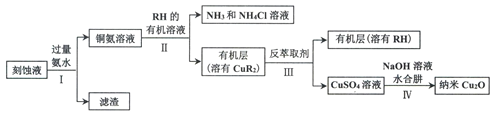
已知:①Cu2O在潮湿的空气中会慢慢氧化生成CuO,也易被还原为Cu; Cu2O不溶于水,极易溶于碱性溶液;Cu2O+2H+ =Cu2++Cu+H2O。
②生成Cu2O的反应:4Cu(OH)2+N2H4H2O=2Cu2O+N2↑+7H2O
请回答:
(1)步骤II,写出生成CuR2反应的离子方程式:____________________________
(2)步骤II,需对水层多次萃取并合并萃取液的目的是___________________________
(3)步骤III,反萃取剂为_____________
(4)步骤IV,①制备纳米Cu2O时,控制溶液的pH为5的原因是_______________
A.  B.
B.  C.
C. 
②从溶液中分离出纳米Cu2O采用离心法,下列方法也可分离Cu2O的是_________
③Cu2O干燥的方法是_________________
(5)为测定产品中Cu2O的含量,称取3.960g产品于锥形瓶中,加入30mL硫酸酸化的Fe2(SO4)3溶液(足量),充分反应后用0.2000 mol·L-1标准KMnO4溶液滴定,重复2~3次,平均消耗KMnO4溶液50.00mL。
①产品中Cu2O的质量分数为_______
②若无操作误差,测定结果总是偏高的原因是_____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在温度、容积相同的3个密闭容器中,按不同方式投入反应物,发生反应N2(g)+3H2(g)![]() 2NH3(g) ΔH= 92.4kJ/mol,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
2NH3(g) ΔH= 92.4kJ/mol,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
容器 | 甲 | 乙 | 丙 |
反应物投入量 | 0.5mol N2、1.5mol H2 | 1mol NH3 | 2mol NH3 |
NH3的浓度(mol/L) | c1 | c2 | c3 |
吸收或放出的热量(kJ) | a | b | c |
体系压强(Pa) | p1 | p2 | p3 |
反应物转化率 | ɑ1 | ɑ2 | ɑ3 |
下列说法正确的是
A.a + b = 46.2B.2c1>c3>c1C.2p2<p3D.ɑ1+ɑ3>1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用铜片、银片设计成如图所示的原电池。以下有关该原电池的叙述正确的是( )
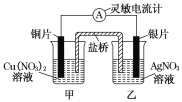
A.电流沿导线由Cu片流向Ag片
B.正极的电极反应是:Ag++e-=Ag
C.Cu片上发生还原反应,Ag片上发生氧化反应
D.反应时盐桥中的阳离子移向Cu(NO3)2溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com