
【题目】铁和钴是两种重要的过渡元素。请回答下列问题:
(1)钴在元素周期表中的位置是___________,其基态原子的价电子排布图为___________。
(2)FeCO3是菱铁矿的主要成分,其中C原子的杂化方式为________;分子中的大π键可用符号Π![]() 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为Π
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为Π![]() ),则CO32-中的大π键应表示为________。
),则CO32-中的大π键应表示为________。
(3)已知Fe2+半径为61pm,Co2+半径为65pm,在隔绝空气条件下分别加热FeCO3和CoCO3,实验测得FeCO3受热分解温度低于CoCO3,其原因可能是______。
(4)Co(NH3)5Cl3是钴的一种配合物,向含0.01mol该配合物的溶液中加入足量AgNO3溶液,生成白色沉淀2.87g。则该配合物的配位数为_____。
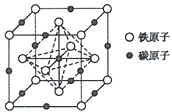
(5)奥氏体是碳溶解在r-Fe中形成的一种间隙固溶体,无磁性,其晶胞为面心立方结构(如图所示),则该晶体中与铁原子距离最近的铁原子数目为___________;若该晶胞参数为a pm,则该晶体的密度为___________g·cm-3(阿伏加德罗常数的值用NA表示)。
【答案】第四周期、第VIII族; ![]() ; sp2;
; sp2; ![]() ; 因为分解后生成的FeO和CoO中,FeO的晶格能更大; 6; 12;
; 因为分解后生成的FeO和CoO中,FeO的晶格能更大; 6; 12; ![]() ;
;
【解析】
(1)根据构造原理得出基态原子价电子排布图;
(2)根据孤电子对数,价层电子对数的相关知识解答。
(3)根据晶格能判断;
(4)根据配合物及配合物的配位数的相关计算解答;
(5)根据晶胞结构以及用均摊法晶胞求解。
(1)Co在元素周期表中位于第4周期第VIII族。根据构造原理,其基态原子价电子排布图为![]() 。
。
(2)CO32-中C的孤电子对数为![]() ×(4+2-3×2)=0,σ键电子对数为3,价层电子对数为3,C为sp2杂化。CO32-中参与形成大π键的原子数是4个,电子数是6个,则CO32-中大π键可表示为
×(4+2-3×2)=0,σ键电子对数为3,价层电子对数为3,C为sp2杂化。CO32-中参与形成大π键的原子数是4个,电子数是6个,则CO32-中大π键可表示为![]() 。
。
(3)在隔绝空气条件下分别加热FeCO3和CoCO3,实验测得FeCO3受热分解温度低于CoCO3,原因是:Fe2+半径为61pm,Co2+半径为65pm,Fe2+的离子半径小于Co2+的离子半径,FeO的晶格能大于CoO的晶格能。
(4)向含0.01mol该配合物的溶液中加入足量AgNO3溶液,生成白色沉淀2.87g,n(AgCl)=2.87g÷143.5g/mol=0.02mol,即配合物中2个Cl-在外界,1个Cl-在内界,则该配合物可表示为[Co(NH3)5Cl]Cl2,该配合物的配位数为6。
(5)根据晶胞结构知,该晶体中与铁原子距离最近的铁原子数目为12个。用均摊法晶胞中含Fe:8×![]() +6×
+6×![]() =4,C:12×
=4,C:12×![]() +1=4,该晶体的化学式为FeC,该晶体的密度为
+1=4,该晶体的化学式为FeC,该晶体的密度为![]() g÷(a×10-10cm)3=
g÷(a×10-10cm)3=![]() g/cm3。
g/cm3。


 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案科目:高中化学 来源: 题型:
【题目】(1)某校研究性学习小组的学生欲制取、收集氨气,并探究氨气的有关性质,请你参与回答实验中的有关问题。
①要收集较纯的干燥氨气,使用的方法是__________________________。
②甲、乙两小组的学生用相同容积的圆底烧瓶各收集一瓶干燥氨气,进行实验.结果都产生了喷泉,说明氨气______溶于水;圆底烧瓶中溶液变红色,说明有_____性物质生成。
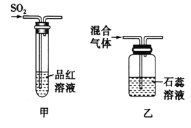
(2)某兴趣小组为验证SO2和Cl2的漂白性,设计了如下方案,请你参与回答下列问题(尾气处理装置未画出)_____。
①如图甲所示,向品红溶液中通入SO2,同学们发现品红溶液褪色了,停止通气体,加热试管,发现溶液又变为红色,说明SO2的漂白是__________(填“可恢复的”或“不可恢复的”)。
②如图乙所示,将干燥的Cl2和SO2按其体积比1:1混合,通入石蕊溶液中,发现石蕊溶液变红,不褪色,试用化学方程式解释之:_____________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)0.6mol O2与0.4mol O3的质量之比为______,分子个数之比为_______,O原子的物质的量之比为______。
(2)49g硫酸是_______mol,含有______mol O,电离可产生______个氢离子。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室从废定影液[含Ag(S2O3)23-和Br-等]中回收Ag和Br2的主要步骤为:向废定影液中加入Na2S溶液沉淀银离子,过滤、洗涤、干燥,灼烧Ag2S制取金属Ag;制取C12并将Cl2通入滤液中氧化Br-,再用苯萃取分液。其中部分实验操作的装置如下图所示:
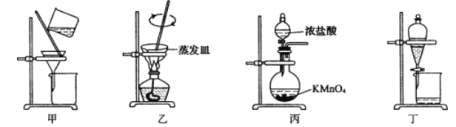
下列叙述正确的是
A. 用装置甲分离Ag2S时,用玻璃棒不断搅拌
B. 用装置乙在通风橱中高温灼烧Ag2S制取Ag
C. 用装置丙制备用于氧化过滤液中Br-的Cl2
D. 用装置丁分液时,先放出水层再换个烧杯继续放出有机层
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化氢(H2O2)在医药、化工、民用等方面有广泛的应用。回答下面问题:
(1)最早制备H2O2使用的原料是易溶于水的BaO2和稀硫酸,发生反应的化学方程式是_____。BaO2的电子式为:__________。
(2)目前工业制备H2O2的主要方法是蒽醌法。反应流程如下:
![]()
已知:乙基蒽醌是反应中的催化剂。
①蒽醌法所用原料的物质的量之比为_____________。
②操作a是__________________。
③再生回收液的成分是______________________。
(3)测量过氧化氢浓度常用的方法是滴定法,某次测定时,取20. 00mL过氧化氢样品,加入过量硫酸酸化,用0. l000mol/L的KMnO4标准溶液滴定至终点,消耗10. 00mL,滴定时发生反应的离子方程式为____,该样品中H2O2的物质的量浓度为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据报道,科学家已经研制出世界上最薄的材料——碳膜片,其厚度只有一根头发的二十万分之一。如图所示,这种碳膜片形状如蜂巢,是由碳原子构成的六边形单元向外延展而成,下列有关碳膜片的说法中,正确的是( )
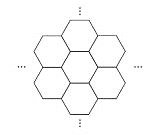
A. 碳膜片属于一种新型的化合物
B. 碳膜片与石墨的结构相同
C. 碳膜片与C60互为同素异形体
D. 碳膜片在氧气中完全燃烧的产物和碳在氧气中完全燃烧的产物不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用海洋资源获得的部分物质如下图所示,有关说法正确的是
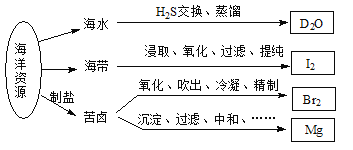
A. 在化学反应中,![]() H2O可转变为D2O
H2O可转变为D2O
B. “加碘食盐”生产中碘添加剂为单质I2
C. 实验室用带玻璃塞的棕色瓶贮存液Br2
D. 电解饱和MgCl2溶液时在阴极得到Mg
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纳米材料一直是人们研究的重要课题,例如纳米级Fe粉表面积大,具有超强的磁性,高效催化性等优良的性质。
I、实验室采用气相还原法制备纳米级Fe,其流程如图所示:

(1)纳米级Fe和稀盐酸反应的离子方程式为_______________________________。
(2)如何将FeCl2·nH2O固体加热脱水制得无水FeCl2 _____________________________________(用简要文字描述)。
(3)生成纳米级Fe的化学方程式为______________________________________。
II、查阅资料:在不同温度下,纳米级Fe粉与水蒸气反应的固体产物不同,温度低于570℃时生成FeO,高于570℃时生成Fe3O4。甲同学用如图甲装置所示进行纳米级Fe粉与水蒸气反应的实验,乙同学用图乙所示的装置进行纳米级Fe粉与水蒸气的反应并验证产物。
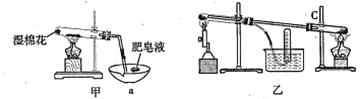
(4)甲装置中纳米级Fe粉与水蒸气反应的化学方程式是 ______________________。
(5)甲装置中仪器a的名称为_______________________。
(6)乙同学为探究实验结束后试管内的固体物质成分,进行了下列实验:
实验步骤 | 实验操作 | 实验现象 |
I | 将反应后得到的黑色粉末X(假定为均匀的),取出少量放入另一试管中,加入少量盐酸,微热 | 黑色粉末逐渐溶解,溶液呈浅绿色;有少量气泡产生 |
II | 向实验I得到的溶液中滴加几滴KSCN溶液,振荡 | 溶液没有出现红色 |
根据以上实验,乙同学认为该条件下反应的固体产物为FeO。
丙同学认为乙同学的结论不正确,他的理由是______(用简要文字描述)。
(7)丁同学称取5.60gFe粉,用乙装反应一段时间后,停止加热。将试管内的固体物质在干燥器中冷却后,称得质量为6.88g,则丁同学实验后的固体物质中氧化物的质量分数为________(结果保留三位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿明洛芬属于苯丙氨酸类抗炎药。镇痛效果优于布洛芬。如图是阿明洛芬的一条合成路线。
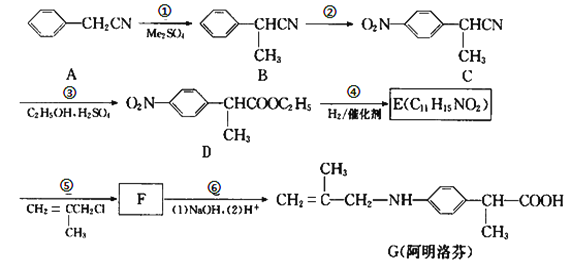
(1)反应①为取代反应,该步反应物Me2SO4中的“Me”表示___,D中官能团的名称是__。
(2)写出E的结构简式___。
(3)写出B到C这步反应的化学方程式___。
(4)G不能发生的反应类型是_____(填字母序号)。
A.水解反应 B.酯化反应 C.还原反应 D.加聚反应 E.缩聚反应
(5)写出F在NaOH溶液中反应的化学方程式_____。
(6)写出所有满足下列条件的B的同分异构体____。
①只含有一个环(即苯环)的芳香族化合物;
②核磁共振氢谱中氢峰的个数相比B的其它同分异构体最少。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com