
| A. | 乙醇催化氧化制乙醛 | B. | 乙醇与浓硫酸共热制乙烯 | ||
| C. | 乙烷与氯气反应制氯乙烷 | D. | 苯乙烯在一定条件下制聚苯乙烯 |
分析 根据绿色化学的定义可知,原料分子中的原子全部转变成所需产物,不产生副产物,实现零排放,以此解答该题.
解答 解:A、乙醇催化氧化制乙醛,同时生成水,原子没有全部利用,故A错误;
B、乙醇与浓硫酸共热制乙烯,同时生成水,原子没有全部利用,故B错误;
C、乙烷与氯气反应除生成氯乙烷外,还有二氯乙烷、三氯乙烷、四氯乙烷等副产物,含有HCl生成,原子利用率不是100%,故C错误;
D、苯乙烯在一定条件下制聚苯乙烯,原料中的原子全部转变成所需要的产物,不产生副产物,实现零排放,故D正确;
故选D.
点评 绿色化学实质是原子利用率是100%,全部转变成所需要的产物,从源头上做起,不浪费、不污染.


 导学全程练创优训练系列答案
导学全程练创优训练系列答案科目:高中化学 来源: 题型:选择题
| A. | CO2的摩尔质量为44g | |
| B. | 1molN2的质量是14g | |
| C. | 标准状况下,1molCO2所占的体积约是22.4L | |
| D. | 将40gNaOH溶于1L水中,所得溶液中NaOH的物质的量浓度为1mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径大小:Na>S>O | B. | 稳定性:HI>HBr>HCl>HF | ||
| C. | 还原性强弱:Cl-<Br-<I- | D. | 碱性强弱:KOH>NaOH>LiOH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ①③⑤ | C. | ②③④ | D. | ②③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使酚酞溶液变红的溶液:Na+、Cl-、SO42-、Fe3+ | |
| B. | 含有大量Al3+的溶液中:Na+、NH4+、SO42-、Cl- | |
| C. | 含有大量Fe3+的溶液中:Na+、Mg2+、NO3-、SCN- | |
| D. | 碳酸氢钠溶液:K+、SO42-、Cl-、H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
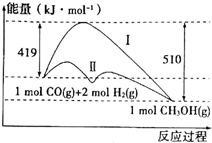 工业上用CO生产燃料甲醇,一定条件下发生反应:CO(g)+2H2(g)?CH3OH(g),反应过程中的能量变化情况如图所示.
工业上用CO生产燃料甲醇,一定条件下发生反应:CO(g)+2H2(g)?CH3OH(g),反应过程中的能量变化情况如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
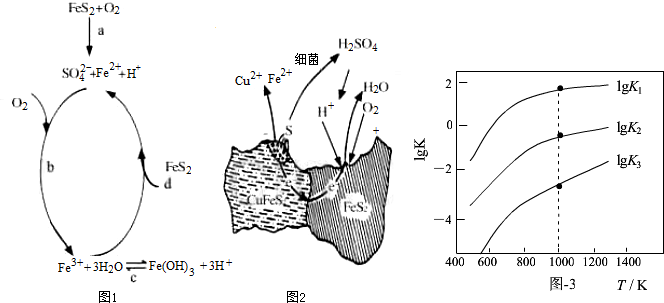
| 相关反应 | 反应热 | 平衡常数K |
| FeS2(s)+H2(g)?FeS(s)+H2S(g) | △H1 | K1 |
| $\frac{1}{2}$FeS2(s)+H2(g)?$\frac{1}{2}$Fe(s)+H2S(g) | △H2 | K2 |
| FeS(s)+H2(g)?Fe(s)+H2S(g) | △H3 | K3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com