
下列化学反应的离子方程式正确的是
A.向沸水中滴加FeCl3溶液制备Fe(OH)3胶体:Fe3++3H2O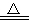 Fe(OH)3↓+3H+
Fe(OH)3↓+3H+
B.往FeCl3溶液中加入Cu粉:2Fe3++Cu=2Fe2++Cu2+
C.碳酸钠溶液与石灰乳的反应:CO32-+Ca2+=CaCO3↓
D.氢氧化钡溶液与稀硫酸反应:Ba2++SO42-+H++OH-=BaSO4↓+H2O
科目:高中化学 来源:2017届内蒙古高三上模拟三化学试卷(解析版) 题型:选择题
含SO2的烟气会形成酸雨,工业上常利用Na2SO3溶液作为吸收液脱除烟气中的SO2。随着SO2的吸收,吸收液的pH不断变化。下列粒子浓度关系一定正确的是
A.Na2SO3溶液中存在:c(Na+)>c(SO32-)>c(H2SO3)>c(HSO3-)
B.已知NaHSO3溶液pH<7,该溶液中:c(Na+)>c(HSO3-)>c(H2SO3)>c(SO32-)
C.当吸收液呈酸性时:c(Na+)=c(SO32-)+c(HSO3-)+c(H2SO3)
D.当吸收液呈中性时:c(Na+)=2c(SO32-)+c(HSO3-)
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山东省高二12月月考化学卷(解析版) 题型:实验题

(I)该硫酸的物质的量浓度是________。
(II)某化学兴趣小组进行硫酸性质的实验探究时,需要240mL1.84mol/L的稀硫酸。可供选抒的仪器由:①玻璃棒 ②烧瓶 ③烧杯 ④胶头滴管 ⑤量筒 ⑥容量瓶 ⑦托盘天平 ⑧药匙 请冋答下列问题:
(1) 上述仪器中,再配置稀硫酸时用不到的有________ (填代号)
(2) 经计算,需:浓硫酸的体积为_____________。现有:
①10mL ②50mL ③100mL三种规格的量筒,你选用的量筒是______ (填代号)
将上述硫酸迸行稀释的实验操作有:___________________。
(3)在配制稀硫酸过程中,其他操作都准确,能引起误差偏高的有:_________ (填代号)
①洗涤量取浓硫酸的量筒,并将洗涤液转移到容量瓶中
②容量瓶用1moll/L稀硫酸润洗
③转移前,容量瓶中含存少量蒸馏水
④量.取浓硫酸时俯视读刻度
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江大庆实验中学高一12月月考化学卷(解析版) 题型:填空题
Fe2O3是一种重要的工业原料。
(1)取少量Fe2O3粉末(红棕色),加入适量盐酸,发生反应的离子方程式为 。
用上述溶液进行以下实验:
(2)取少量溶液置于试管中,滴入NaOH溶液,反应的化学方程式为 。
(3)在小烧杯中加入20mL 蒸馏水,加热至沸腾后,向沸水中滴入几滴FeCl3溶液,继续煮沸直至溶液呈
色,即可制得Fe(OH)3胶体。电泳实验时, (填“阳”或“阴”)极颜色加深。
(4)已知强酸氢碘酸(HI)具有较强的还原性。取上述烧杯中少量Fe(OH)3胶体置于试管中,向试管中滴加一定量的HI稀溶液,边滴边振荡,会出现一系列变化。先出现红褐色沉淀,原因是 。
]随后沉淀溶解,溶液呈黄色,最后溶液颜色加深。若此时向该溶液中加淀粉溶液,溶液变蓝,请写出Fe(OH)3与HI反应的离子方程式 。
(5)已知:氧化性:Cl2>Br2>Fe3+>I2  则
则
向FeBr2溶液中通入等物质的量的 Cl2的总离子方程式为 。
向FeI2溶液中通入等物质的量的 Cl2的总离子方程式为 。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江大庆实验中学高一12月月考化学卷(解析版) 题型:选择题
下列说法正确的是
A.可用托盘天平称取25.2gNaCl固体,也可用10mL量筒取5.20mL的盐酸
B.失电子数越多的原子还原性越强
C.KMnO4→MnO2、H2S→SO2两个变化过程均需要加入还原剂才能实现
D.饱和电解质溶液不一定比饱和非电解质溶液导电能力强
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江大庆实验中学高一12月月考化学卷(解析版) 题型:选择题
下列说法不正确的是
A.明矾与水反应成的Al(OH)3胶体能吸附水中悬浮物,可用于水的净化
B.当光束通 过鸡蛋清水溶液时,能观察到丁达尔效应
过鸡蛋清水溶液时,能观察到丁达尔效应
C.烟、云、雾、豆浆、碘酒等分散系中分散质粒子直径均在1-100nm范围内
D.胶体不一定是透明的,但胶体粒子都能透过滤纸
查看答案和解析>>
科目:高中化学 来源:2016-2017学年广东省高一上大考二化学卷(解析版) 题型:填空题
Ⅰ.写出碳酸氢钠和次氯酸在水溶液中的电离方程式 、 。
Ⅱ.某无色透明溶液中可能大量存在Ag+、Al3+、Cu2+、Fe3+、Na+中的几种,回答下列问题:
(1)不做任何实验就可以肯定原溶液中不存在的离子是___________。
(2)取少量原溶液,加入过量稀盐酸,有白色沉淀生成;再加入过量的稀硝酸,沉淀不消失。说明原溶液中肯定存在的离子是_______________。
(3)取(2)中的滤液,加入过量的稀氨水(NH3·H2O),出现白色沉淀,说明原溶液中肯定有___________,有关的离子方程式为______________________。
(4)原溶液可能大量存在的阴离子是下列的___________。
A.Cl- B.NO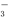
C.CO D.OH-
D.OH-
(5)请设计实验证明原溶液中有钠离子(写出详细实验操作过程及现象) __________________。
查看答案和解析>>
科目:高中化学 来源:2017届河北省高三上调研四化学试卷(解析版) 题型:实验题
在实验室中某实验小组同学关于硫酸铜的制取和应用,设计了以下实验:
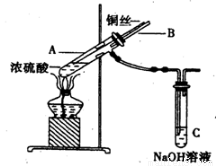
(1)装置A中发生反应的化学方程式为________________________。
(2)为符合绿色化学的要求,某同学进行如下设计:将铜粉在___________(填仪器名称)中反复的灼烧,使铜与空气充分反应生成氧化铜,再将氧化铜与稀硫酸反应,反应后溶液经过_________、___________、过滤、洗法、干燥,即可得到产品CuSO4·5H2O晶体。
(3)将空气或氧气直接通入到钢粉与稀硫酸的混合物中,发现在常温下几乎不反应。向反应液中加少量FeSO4作催化剂,即发生反应,生成硫酸铜。其反应过程的第2步是:___________,Fe3++Cu==2Fe2++Cu2+,请写出其第1步反应的离子方程式_________________。
(4)制取的CuSO4溶液和“另一物质”在40~50℃混合时生成了一种难溶物质氢化亚铜(CuH)。将CuH溶解在稀盐酸中时生成了一种气体,这种气体是 _____________,经收集测定生成的该气体为标况下11.2 L,则被还原的离子得电子的物质的量是___________。
查看答案和解析>>
科目:高中化学 来源:2017届宁夏高三上月考四化学试卷(解析版) 题型:填空题
【化学——选修3:物质结构与性质】
请回答下列问题:
(1)写出硅原子基态时的核外电子排布式:______________。硅元素位于元素周期表的第_________族。
(2)从晶体类型来看,金刚石属于_________晶体。
(3)甲烷分子中碳原子的杂化方式为________。SO42-的空间构型为_______________。
(4)实验测定HF的相对分子质量时,实验测定值一般高于理论值的原因是______________。
(5)NaCl和CsCl熔点高的是 ,(填化学式)其主要原因是 。
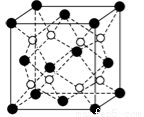
(6)CaF2晶胞结构如图所示,该晶体的密度为a g/cm3,则晶胞的体积是 (只要求列出算式)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com