
NA为阿伏加德罗常数,下列对3mol•L﹣1硫酸钾溶液的说法正确的是( )
|
| A. | 1 L溶液中含3NA个K+ |
|
| B. | 1 L溶液中含NA个 |
|
| C. | 1 L溶液中K+浓度是6 mol•L﹣1 |
|
| D. | 1 L溶液中含6NA个离子 |
考点:
阿伏加德罗常数.
专题:
阿伏加德罗常数和阿伏加德罗定律.
分析:
A.根据n=cV及硫酸钾的化学式计算出溶液中含有的钾离子的数目;
B.根据硫酸钾的化学式组成及n=cV计算出硫酸根离子的物质的量及数目;
C.根据硫酸钾的浓度及硫酸钾的化学式计算出钾离子的浓度;
D.3mol硫酸钾中,钾离子和硫酸根离子总物质的量为9mol.
解答:
解:1L 3mol•L﹣1硫酸钾溶液中含有硫酸钾的物质的量为:3mol/L×1L=3mol,
A.1L 3mol•L﹣1硫酸钾溶液中含有3mol硫酸钾,则含有6mol钾离子,含6NA个K+,故A错误;
B.1L该溶液中含有3mol硫酸钾,则含有3mol硫酸根离子,含3NA个硫酸根离子,故B错误;
C.1L该溶液中含有硫酸钾的浓度为3mol/L,则钾离子的浓度为6mol/L,故C正确;
D.1L溶液中含有3mol硫酸根离子、6mol钾离子,总共含有9mol离子,故D错误;
故选C.
点评:
本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,明确硫酸钾的化学式组成与钾离子、硫酸根离子之间关系是解题关键.


 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案科目:高中化学 来源: 题型:
下列方法能达到实验目的是( )
A. 用浓硫酸干燥NH3
B. 用四氯化碳萃取碘水中的碘单质
C. 用NaOH固体干燥Cl2
D. 将Na在O2中燃烧以制取Na2O
查看答案和解析>>
科目:高中化学 来源: 题型:
生活中可以用氯气灌洞的方法来消灭田鼠,这是利用了氯气的哪些性质:①密度比空气大②易液化③能溶于水④有毒( )
|
| A. | ①② | B. | ③④ | C. | ④ | D. | ①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
胶体区别于其他分散系的本质特征是( )
|
| A. | 胶体的分散质能通过滤纸空隙,而浊液的分散质不能 |
|
| B. | 产生丁达尔现象 |
|
| C. | 分散质粒子直径在1nm~100nm之间 |
|
| D. | 胶体在一定条件下能稳定存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:
用漂白粉溶液浸泡过的有色布条,如果晾置在空气中,过了一段时间,其漂白效果会更好的原因可能是( )
|
| A. | 漂白粉被氧化了 |
|
| B. | 有色布条被空气中的氧气氧化了 |
|
| C. | 漂白粉跟空气中的CO2反应充分,生成了较多量的HClO |
|
| D. | 漂白粉溶液蒸发掉部分水,其浓度增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室配制500mL 2mol/L的H2SO4溶液.
(1)500mL 2mol/L的H2SO4溶液中所含溶质的质量是 g.
(2)配制时,所需仪器应该有烧杯、玻璃棒、量筒、 、 .
(3)容量瓶在使用前,首先应检查 .
(4)此实验中,玻璃棒的两个作用分别是 、 .
(5)下列操作会使配制的溶液浓度偏低的是 (选填序号)
A.没有将洗涤液转移到容量瓶B.定容时俯视刻度线
C.容量瓶洗净后未干燥D.转移过程中有少量溶液溅出.
查看答案和解析>>
科目:高中化学 来源: 题型:
将SO2通入BaCl2溶液并不产生沉淀,而通入另一种气体后可以产生白色沉淀.则右侧Y形管中放置的药品组合不符合要求的是(必要时可以加热)( )
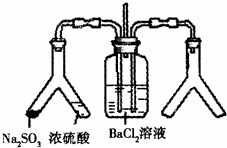
|
| A. | 石灰石和稀硝酸 | B. | CaO和氯化铵 |
|
| C. | Cu和浓硝酸 | D. | Na2O2和食盐水 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列物质的转化在给定条件下能实现的是( )
①NaAlO2(aq) AlCl3
AlCl3 Al
Al
②NH3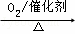 NO
NO HNO3
HNO3
③NaCl(饱和)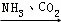 NaHCO3
NaHCO3 Na2CO3
Na2CO3
④FeS2 SO3
SO3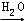 H2SO4.
H2SO4.
A. ②③ B. ①④ C. ②④ D. ③④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com