
����Ŀ���黯�أ�GaAs���������İ뵼����ϣ������������ͼ�������̫���ܵ�صIJ��ϵȣ��ش��������⣺
��1��д����̬Asԭ�ӵĺ�������Ų�ʽ ��
��2������Ԫ�������ɣ�ԭ�Ӱ뾶GaAs����һ������GaAs��������ڡ���С�ڡ���
��3��AsCl3���ӵ����幹��Ϊ �� ����As���ӻ��������Ϊ ��
��4��GaF3���۵����1000�棬GaCl3���۵�Ϊ77.9�棬��ԭ���� ��
��5��GaAs���۵�Ϊ1238�棬�ܶ�Ϊ�� gcm��3 �� �侧���ṹ��ͼ��ʾ���þ��������Ϊ �� Ga��As�������ϣ�Ga��As��Ħ�������ֱ�ΪMGa gmol��1��MAs gmol��1 �� ԭ�Ӱ뾶�ֱ�ΪrGa pm��rAs pm������٤������ֵΪNA �� ��GaAs������ԭ�ӵ����ռ��������İٷ���Ϊ �� 
���𰸡�
��1��1s22s22p63s23p63d104s24p3
��2�����ڣ�С��
��3��������sp3
��4��GaF3Ϊ���Ӿ��壬GaCl3Ϊ���Ӿ��壬���Ӿ�����۵��
��5��ԭ�Ӿ��壻���ۣ�![]() ��100%
��100%
���������⣺��1.��AsΪ��A��33��Ԫ�أ������Ų�ʽΪ��1s22s22p63s23p63d104s24p3 �� �ʴ�Ϊ��1s22s22p63s23p63d104s24p3��
��2.������Ԫ�������ɣ�Ga��Asλ��ͬһ���ڣ�Gaԭ������С��As���ʰ뾶Ga����As��ͬ���ڵ�һ�����ܴ����ң������ʵ�һ������GaС��As���ʴ�Ϊ�����ڣ�С�ڣ�
��3.��AsCl3�м۲���ӶԸ���=�Ҽ�����+�µ��ӶԸ���=3+ ![]() =4������ԭ���ӻ���ʽ��sp3 �� ������һ�Թ¶Ե��Ӷԣ����ӿռ乹��Ϊ�����Σ��ʴ�Ϊ�������Σ�sp3��
=4������ԭ���ӻ���ʽ��sp3 �� ������һ�Թ¶Ե��Ӷԣ����ӿռ乹��Ϊ�����Σ��ʴ�Ϊ�������Σ�sp3��
��4.��GaF3���۵����1000�棬GaCl3���۵�Ϊ77.9�棬��ԭ����GaF3Ϊ���Ӿ��壬GaCl3Ϊ���Ӿ��壬���Ӿ�����۵�ߣ�
�ʴ�Ϊ��GaF3Ϊ���Ӿ��壬GaCl3Ϊ���Ӿ��壬���Ӿ�����۵�ߣ�
��5.��GaAs���۵�1238�棬�۵�ϸߣ��Թ��ۼ�����γ�����ԭ�Ӿ��壬�ܶ�Ϊ�� gcm��3 �� ���ݾ�̯�����㣬As�� ![]() ��Ga��4��1=4�����侧����ԭ����ռ�����V1=��
��Ga��4��1=4�����侧����ԭ����ռ�����V1=�� ![]() ����10��30 �� ���������V2=
����10��30 �� ���������V2= ![]() =
= 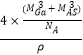 ����GaAs������ԭ�ӵ����ռ��������İٷ���Ϊ
����GaAs������ԭ�ӵ����ռ��������İٷ���Ϊ ![]() ��V1��V2�������ðٷ���=
��V1��V2�������ðٷ���= ![]() ��100%���ʴ�Ϊ��ԭ�Ӿ��壻���ۣ�
��100%���ʴ�Ϊ��ԭ�Ӿ��壻���ۣ� ![]() ��100%��
��100%��
��1.��AsΪ��A��33��Ԫ�أ������Ų�ʽΪ��1s22s22p63s23p63d104s24p3��
��2.��ͬһ���ڣ�ԭ������ԽС�뾶Խ��ͬ���ڵ�һ�����ܴ����ң�������
��3.��AsCl3�м۲���ӶԸ���=�Ҽ�����+�µ��ӶԸ���=3+ ![]() =4������ԭ���ӻ���ʽ��sp3 �� ������һ�Թ¶Ե��Ӷԣ����ӿռ乹��Ϊ�����Σ�
=4������ԭ���ӻ���ʽ��sp3 �� ������һ�Թ¶Ե��Ӷԣ����ӿռ乹��Ϊ�����Σ�
��4.��GaF3���۵����1000�棬GaCl3���۵�Ϊ77.9�棬��ԭ����GaF3Ϊ���Ӿ��壬GaCl3Ϊ���Ӿ��壬���Ӿ�����۵�ߣ�
��5.��GaAs���۵�Ϊ1238�棬�۵�ϸߣ��Թ��ۼ�����γ�����ԭ�Ӿ��壬�ܶ�Ϊ�� gcm��3 �� ���ݾ�̯�����㣬As�� ![]() ��Ga��4��1=4�����侧����ԭ����ռ�����V1=��
��Ga��4��1=4�����侧����ԭ����ռ�����V1=�� ![]() ����10��30 �� ���������V2=
����10��30 �� ���������V2= ![]() =
=  ����GaAs������ԭ�ӵ����ռ��������İٷ���Ϊ
����GaAs������ԭ�ӵ����ռ��������İٷ���Ϊ ![]() ��V1��V2�������ðٷ���=
��V1��V2�������ðٷ���= ![]() ��100%
��100%



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NAΪ����٤��������ֵ������˵����ȷ���ǣ� ��
A.1molFeCl2��1molCl2��Ӧʱת�Ƶĵ�����Ϊ2NA
B.2g H218O��D216O�Ļ����������������ĿΪNA
C.273K��101kPa�£�28g��ϩ���ϩ������к���C��H������ĿΪ5NA
D.pH=1��H2SO3��Һ10L����H+����ĿΪ2NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������Դ����Ǧ���ء��ŵ�ʱ�ĵ�ط�ӦΪ��PbO2+Pb+2H2SO4��2PbSO4+2H2O�����ݴ˷�Ӧ�ж�����˵����ȷ���ǣ�������
A.������Ӧʽ��Pb��2e��+SO42����PbSO4B.��طŵ�ʱ����Һ��������ǿ
C.PbO2�õ��ӣ�������D.PbO2�ǵ�صĸ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������Ҫ��ش��������⣺
��1�����������![]() ��
��![]()
![]() ��
��![]()
![]() ��D��
��D��![]() ���ʯ��ʯī
���ʯ��ʯī![]() ��
��![]() ����Ϊͬλ�ص���_________����Ϊͬ�����������________����������ȣ������ܻ���Ϊͬλ�ص��� ______��
����Ϊͬλ�ص���_________����Ϊͬ�����������________����������ȣ������ܻ���Ϊͬλ�ص��� ______��
��2�����и������ʣ�![]()
![]()
![]() ��Na2O2 ��MgCl2
��Na2O2 ��MgCl2 ![]() �������ڻ�ѧ������______��ֻ�������Ӽ�����______�����ڹ��ۻ��������________�����Ǽ��Լ������ӻ������� _________ ��
�������ڻ�ѧ������______��ֻ�������Ӽ�����______�����ڹ��ۻ��������________�����Ǽ��Լ������ӻ������� _________ ��
��3�����б仯���̣�![]() �������
������� ![]() NaCl��������ˮ
NaCl��������ˮ ![]() O2����ˮ
O2����ˮ ![]() HCl��������ˮ
HCl��������ˮ![]() �ռ��ۻ�
�ռ��ۻ� ![]() �Ȼ�����ȷֽ�����ѧ��û�б��ƻ�����__________�� ���ƻ����Ӽ�����__________�����ƻ����ۼ�����__________��
�Ȼ�����ȷֽ�����ѧ��û�б��ƻ�����__________�� ���ƻ����Ӽ�����__________�����ƻ����ۼ�����__________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������ض�����Ҫ�Ĺ�ҵ��Ʒ����ҵƷ�������ص���Һ�к���ijЩ����������ʣ��������ӽ���Ĥ������ᴿ���乤��ԭ����ͼ2��ʾ�������й�˵���������

A. ��ҵұ�������õ��ǵ�ⷨ
B. ��������������Һ��Ӧ�����ӷ���ʽ��2A1+2OH-+2H2O=2A1O2-+3H2��
C. ͼ�е��۵�������Ӧʽ��2H2O-4e-=4H++O2��
D. ��ȥ���ʺ������������Һ��ͼ�е�B������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й�ʵ���Ұ�ȫ��˵����װ����ȷ����
��������ԭ�Ȼ�ͭʵ���У�Ӧ��ͨ���������������ͭ
������ʯ��ʱ������һ��ʱ�����δ�����Ƭ�����̰ο���Ƥ����Ͷ�����Ƭ
��ʵ���ҽ����Ƶ���ʾʵ��ʱ�����µ���мͶ���Һ����
������ͼװ���ư�ˮ
�ݽ������Ż�ʱ��ʹ����ĭ��������
��ʵ������У���ȼ�ױ���ѧҩƷ�������������
�߲�����Ũ���ὦ��Ƥ���ϣ�Ӧ������ϡ����������Һ��ϴ
��ϡ��Ũ����ʱ��Ӧ��Ũ�����������������뵽ˮ�У��������ò��������裬��ʹ������������ʱɢʧ

A. �٢ڢޢ� B. �٢ޢ� C. �٢ۢޢ� D. �٢ݢޢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�о���ѧϰС�������һ��ʵ����̽��Ԫ�������ɡ���ͬѧ����Ԫ�ؽ��������Ӧ����������ˮ����֮��Ĺ�ϵ�������ͼװ�ã��������N��C��Si�ķǽ�����ǿ���Ƚϵ�ʵ���о�����ͬѧ�����û���Ӧ�Ĺ��ɣ�������ͼװ�������Cl��Br�ķǽ�����ǿ����ʵ���о����ش��������⣺

��1��ͼ������E��������_______________��ʹ��ǰһ��Ҫ_____________________��
��2������������������ѡ����ͬѧ��Ƶ�ʵ�����õ����ʣ��Լ�AΪ____���Լ�CΪ____(�����)��
��������Һ ��ϡ���� ��̼��� ��Na2SiO3��Һ ��SiO2
��3����ͬѧ��Ϊ��ͬѧ����д��ڴ�����ȱ�ݣ���ָ����ȱ��_________________________��
��4����ͬѧ��Ƶ�ʵ���У��ƾ��Ƽ���װ����ͼ��δ�����������Լ�CΪ�廯����Һ�⣬����Ҫ�õ����Լ��У��Լ�AΪ_______________���Լ�BΪ_________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ͼ��ʾװ�ý�������ʵ�飬����ȷ����ʵ�鲢�ó���Ӧʵ����۵����� ��
ѡ�� | �� | �� | �� | ʵ����� |
|
A | Ũ��ˮ | CaO | AlCl3��Һ | �Ʊ��������� | |
B | NaCl��Һ | ��ʯ | ����KMnO4 | ��Ȳ���л�ԭ�� | |
C | Ũ���� | Na2CO3 | Na2SiO3��Һ | �ǽ����ԣ�N��C��Si | |
D | ϡ���� | Na2S | Ag2SO4��Һ | Ksp(Ag2SO4)��Ksp(Ag2S) |
A. A B. B C. C D. D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��1 L 5 moI/L��KI��Һ�У�������KI�����ʵ�����
A.0.2 molB.0.5 molC.2 molD.5 mol
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com