
【题目】Ⅰ. 试分析比较合成氨与用SO2和O2反应制SO3的反应:
(1)某些相同点: ①△H ______ 0;②△S ______ 0(填<、=、>);③反应在 ______ 均能自发进行。
(2)条件选择中,主要的三方面不同点?并说明原因和理由?
①______;② ______;③______。
(3)请作出这类反应的“反应过程与能量变化”示意图________________________
Ⅱ.(4)SO2处理的一种方法是用石灰吸收(“钙基固硫”),其最终生成 ______ (写名称);
(5)实验室里可用“在浓氨水中加生石灰”的方法制取氨气,其理由是 ______ 。
【答案】![]()
![]() 低温下
低温下 ![]() 氧化在常压下,而合成氨需要高压;因常压下
氧化在常压下,而合成氨需要高压;因常压下![]() 转化率已较大,可减少能耗
转化率已较大,可减少能耗 ![]() 氧化通常鼓入过量空气,使
氧化通常鼓入过量空气,使![]() 进一步转化又减少尾气处理的压力,而合成氨
进一步转化又减少尾气处理的压力,而合成氨![]() 、
、![]() 转化率小,常剩余而循环使用
转化率小,常剩余而循环使用![]() 仅补充原料气
仅补充原料气![]()
![]() 氧化的催化剂是
氧化的催化剂是![]() ,它参加反应而催化;合成氨的催化剂是铁触媒,它通过表面吸附而催化
,它参加反应而催化;合成氨的催化剂是铁触媒,它通过表面吸附而催化 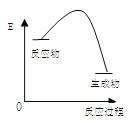 硫酸钙 生石灰与水反应生成氢氧化钙时放出热量、又碱性增强,都能促使一水合氨的分解,促进氨气的逸出
硫酸钙 生石灰与水反应生成氢氧化钙时放出热量、又碱性增强,都能促使一水合氨的分解,促进氨气的逸出
【解析】
(1)工业合成氨气和二氧化硫催化氧化成三氧化硫,都属于放热反应、正方向气体体积减小的反应,均不需要高温,据此解答即可;
(2)工业合成氨气,条件为加热,催化剂和高压,二氧化硫合成三氧化硫为:加热、催化剂,且为了增加二氧化硫的转化率需要加入足量的氧气,据此解答即可;
(3)放热反应:生成物的总能量高于生成物的总能量,据此画图即可;
(4)亚硫酸盐容易被空气中的氧气氧化生成硫酸盐,据此解答即可;
(5)生石灰是氧化钙,溶于水放出大量的热,据此解答即可。
![]() 工业合成氨气和二氧化硫催化氧化成三氧化硫,都属于放热反应、正方向气体体积减小的反应,均不需要高温,故共同点有:
工业合成氨气和二氧化硫催化氧化成三氧化硫,都属于放热反应、正方向气体体积减小的反应,均不需要高温,故共同点有:![]() ,
,![]() ,
,![]() 均能在低温下反应;
均能在低温下反应;
![]() 氧化在常压下,而合成氨需要高压,因常压下
氧化在常压下,而合成氨需要高压,因常压下![]() 转化率已较大,可减少能耗;
转化率已较大,可减少能耗;
![]() 氧化通常鼓入过量空气,使
氧化通常鼓入过量空气,使![]() 进一步转化又减少尾气处理的压力;而合成氨
进一步转化又减少尾气处理的压力;而合成氨![]() 、
、![]() 转化率小,常剩余而循环使用
转化率小,常剩余而循环使用![]() 仅补充原料气
仅补充原料气![]() ;
;
![]() 氧化的催化剂是
氧化的催化剂是![]() ,它参加反应而催化;合成氨的催化剂是铁触媒,它通过表面吸附而催化;
,它参加反应而催化;合成氨的催化剂是铁触媒,它通过表面吸附而催化;
![]() 放热反应特点:生成物的总能量高于生成物的总能量,故图象为:
放热反应特点:生成物的总能量高于生成物的总能量,故图象为: ;
;
![]() 亚硫酸盐容易被空气中的氧气氧化生成硫酸盐,故钙基固硫最终产物为硫酸钙;
亚硫酸盐容易被空气中的氧气氧化生成硫酸盐,故钙基固硫最终产物为硫酸钙;
![]() 生石灰是氧化钙,溶于水放出大量的热,故生石灰与水反应生成氢氧化钙时放出热量、又碱性增强,都能促使一水合氨的分解,促进氨气的逸出。
生石灰是氧化钙,溶于水放出大量的热,故生石灰与水反应生成氢氧化钙时放出热量、又碱性增强,都能促使一水合氨的分解,促进氨气的逸出。


科目:高中化学 来源: 题型:
【题目】有机物命名时,取代基的编号必须满足“最低系列”。即当存在碳链编号不同时,得到两种或两种以上不同的编号系列,此时应顺次逐项比较各系列不同的位次,最先遇到位次编号最小者定为“最低系列”。若有多种官能团,必须按官能团的优先次序,使官能团的编号满足“最低系列”,碳碳双键比卤素原子优先。例如: ![]() 命名为1,6-二溴-1,3,5,7-环辛四烯(或简称1,6-二溴环辛四烯)则
命名为1,6-二溴-1,3,5,7-环辛四烯(或简称1,6-二溴环辛四烯)则 ![]() 的命名为( )
的命名为( )
A.1,2-二溴环辛四烯B.1,8-二溴环辛四烯
C.2,3-二溴环辛四烯D.2,8-二溴环辛四烯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】许多过渡金属离子对多种配体有很强结合力,能形成种类繁多的配合物。下列说法错误的是( )
A.CuCl2溶液呈黄绿色,是由于存在配离子[CuCl4]2-
B.配合物[PtCl2(NH3)2]为平面结构,存在顺反异构体
C.配合物[Ti(OH)4(H2O)2]2+中Ti4+的配位数是4
D.向配合物[TiCl(H2O)5]Cl2·H2O溶液中加入足量AgNO3溶液,只有![]() 的Cl被沉淀
的Cl被沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】微型纽扣电池在现代生活中有广泛应用,有一种银锌电池,其电极分别是Ag2O和Zn,电解质溶液为KOH溶液,总反应为Ag2O+Zn=ZnO+2Ag,其中一个电极反应为Ag2O+H2O+2e-=2Ag+2OH-。

(1)判断正负极的材料。
负极材料_____________,正极材料___________。
(2)写出另一电极的电极反应式,并判断反应类型。
电极反应式__________
反应类型___________
(3)判断电池工作时,电子的流动方向和电解质溶液中离子的流动方向。电子由______到______,溶液中的阳离子流向电池的________,阴离子流向________
(4)在电池使用的过程中,电解质溶液中KOH的物质的量怎样变化?________(增大、减小、不变)
(5)当电池工作时通过电路对外提供了1 mol电子,计算消耗的负极的质量_______。
(6)氢氧燃料电池为绿色化学电源,在碱性NaOH溶液为电解质溶液时的负极电极反应式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙、丁四种物质中,甲、乙、丙均含有相同的某种元素,它们之间具有如下转化关系:![]() 。下列有关物质的推断不正确的是
。下列有关物质的推断不正确的是
A. 若甲为Cl2,则丁可能是铁B. 若甲为NH3,则丁可能是氧气
C. 若甲为AlCl3溶液,则丁可能是氨水D. 若甲为NaOH,则丁可能是SO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取含HCl和MgSO4的混合溶液1L,逐滴加入1molL﹣1的Ba(OH)2溶液,如图为产生沉淀的物质的量(n)与加入Ba(OH)2溶液体积(V)间的关系图,请回答下列问题:
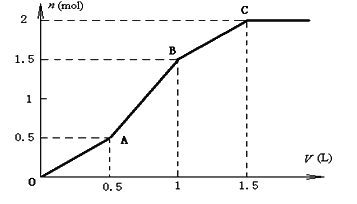
(1)OA段生成沉淀的化学式为______;
(2)AB段生成沉淀的离子方程式为:______;
(3)原溶液中的c(HCl)=______molL﹣1.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气与氧气生成水的反应是氢能源应用的重要途径。下列有关说法正确的是
A. 一定温度下,反应2H2(g)+O2(g) ![]() 2H2O(g)能自发进行,该反应的ΔH<0
2H2O(g)能自发进行,该反应的ΔH<0
B. 氢氧燃料电池的负极反应为O2+2H2O+4e![]() 4OH
4OH
C. 常温常压下,氢氧燃料电池放电过程中消耗11.2 L H2,转移电子的数目为6.02×1023
D. 反应2H2(g)+O2(g) ![]() 2H2O(g)的ΔH可通过下式估算:
2H2O(g)的ΔH可通过下式估算:
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 铁表面镀铜时,将铁与电源的正极相连,铜与电源的负极相连
B. 0.01 mol Cl2通入足量水中,转移电子的数目为6.02×1021
C. 反应3C(s)+CaO(s)===CaC2(s)+CO(g)在常温下不能自发进行,说明该反应的ΔH>0
D. 加水稀释0.1 mol·L-1CH3COOH溶液,溶液中所有离子的浓度均减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学分别设计了如图1、2所示的实验。请回答相关问题。
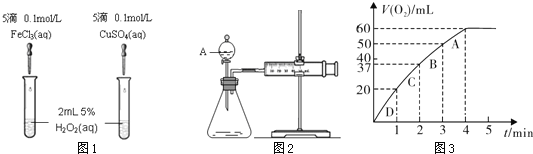
(1)定性如图1可通过观察_______,定性比较得出结论。有同学提出将FeCl3改为0.05 mol/L Fe2(SO4)3更为合理,其理由是_______。
(2)定量如图2所示,实验时均生成40 mL气体,其它可能影响实验的因素均已忽略。实验中需要测量的数据是_________。
(3)加入0.10 mol MnO2粉末于50 mL H2O2溶液中,在标准状况下放出气体的体积和时间的关系如图3所示。
①写出H2O2在二氧化锰作用下发生反应的化学方程式________________。
②实验时放出气体的总体积是________mL。
③A、B、C、D各点反应速率快慢的顺序为:___>___>___>___。
解释反应速率变化的原因___________________。
④H2O2的初始物质的量浓度是___________(请保留两位有效数字)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com