
| A. | ①②④ | B. | ③⑥ | C. | ②④ | D. | ①③⑤⑥ |
分析 ①无色透明溶液不存在有颜色的离子;
②pH=11的溶液呈碱性;
③加入Al能放出H2的溶液可能呈强碱性或为非氧化性酸溶液;
④由水电离出的c(OH-)=10-4mol•L-1的溶液水的电离受到促进,可为水解呈酸性或碱性的盐溶液;
⑤与Fe3+反应的离子不能大量共存;
⑥离子之间发生氧化还原反应.
解答 解:①MnO4-有颜色,不能大量存在于无色透明溶液中,故错误;
②pH=11的溶液呈碱性,碱性条件下离子之间不发生任何反应,可大量共存,故正确;
③加入Al能放出H2的溶液可能呈强碱性或为非氧化性酸溶液,无论呈酸性还是碱性,HCO3-都不能大量共存,故错误;
④由水电离出的c(OH-)=10-4mol•L-1的溶液水的电离受到促进,可为水解呈酸性或碱性的盐溶液,酸性条件下,离子之间不发生任何反应,可大量共存,故正确;
⑤SCN-与Fe3+发生反应而不能大量共存,故错误;
⑥酸性条件下硝酸根离子具有强氧化性,亚铁离子、碘离子不能大量共存,故错误.
故选C.
点评 本题考查离子共存的正误判断,为高考的高频题,题目难度中等,注意明确离子不能大量共存的一般情况:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间;能发生络合反应的离子之间(如 Fe3+和 SCN-)等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;溶液的具体反应条件,如“氧化还原反应”、“加入铝粉产生氢气”;是“可能”共存,还是“一定”共存等.


科目:高中化学 来源: 题型:实验题

| 序号 | 气体 | 装置连接顺序(填字母) | 制备反应的化学方程式 |
| (1) | 乙烯 | B→D→E | CH3-CH2-OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O |
| (2) | 乙炔 | A→C→E | CaC2+2H2O→Ca(OH)2+C2H2↑ |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 序号 | 反应 温度/℃ | c(H2O2)/ mol•L-1 | V(H2O2) /mL | m(MnO2) /g | t/min |
| 1 | 20 | 2 | 10 | 0 | t1 |
| 2 | 20 | 2 | 10 | 0.1 | t2 |
| 3 | 20 | 4 | 10 | 0.1 | t3 |
| 4 | 40 | 2 | 10 | 0.1 | t4 |
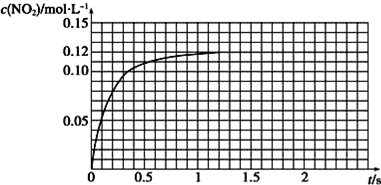
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.4g Mg在足量O2中燃烧,转移的电子数为0.1NA | |
| B. | 标准状况下,5.6L CO2气体中含有氧原子数为0.5NA | |
| C. | 氢原子数为0.4NA的CH3OH分子中含有的σ键数为0.4NA | |
| D. | 0.1L 0.5mol•L-1 CH3COOH溶液中含有的H+数为0.05NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3 种 | B. | 4 种 | C. | 5 种 | D. | 6 种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将铜片放入稀硫酸中,无现象.若再向所得溶液中加入硝酸银溶液,一段时间后,可看到有氢气生成 | |
| B. | 将除去氧化膜的相同大小、相同质量的镁条和铝条与相同浓度NaOH溶液反应,前者速率大于后者 | |
| C. | 两支试管中分别加入相同质量的氯酸钾,其中一支试管中再加入少量二氧化锰,同时加热,产生氧气的快慢不同 | |
| D. | 大理石和盐酸反应制取CO2,增加大理石的用量可加快反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2O2的相对分子质量为34g | |
| B. | CH4的摩尔质量为16 g | |
| C. | 1 mol SO42--的质量为96g | |
| D. | 标准状况下1 mol H2O 的体积是22.4 L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com