
(12分)饮用水中含有一定浓度的NO3一将对人类健康产生危害,NO3一能氧化人体血红蛋白中的Fe(II),使其失去携氧功能。为了降低饮用水中NO3一的浓度,某兴趣小组提出如下方案:
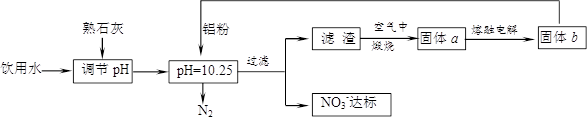
请回答下列问题:
⑴已知过滤后得到的滤渣是一种混合物,则在溶液中铝粉和NO3一反应的离子方程式为
__________________________________________。
⑵该方案中选用熟石灰调节pH,理由是_______________________、__________________,在调节pH时,若pH过大或过小都会造成 的利用率降低。
⑶用H2催化还原法也可降低饮用水中NO3-的浓度,已知反应中的还原产物和氧化产物均可参与大气循环,则催化还原法的离子方程式为____________________________________。
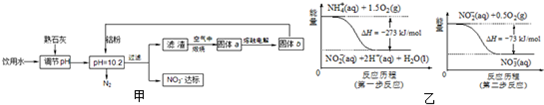
⑷饮用水中的NO3- 主要来自于NH4+。已知在微生物作用的条件下,NH4+ 经过两步反应被氧化成NO3- 。两步反应的能量变化示意图如下:
试写出1 mol NH4+ (aq)全部氧化成NO3- (aq)的热化学方程式是 。
 名校联盟快乐课堂系列答案
名校联盟快乐课堂系列答案科目:高中化学 来源: 题型:
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
a.微碱性条件下用Fe2+还原,还原产物为NH3。
b.pH=10.25时,用铝粉还原,![]() 的还原产物主要为N2。
的还原产物主要为N2。
c.在催化剂作用下用氢气还原,还原产物主要为N2。
(1)a方案中的一种产物还有净水作用,这种物质是______________。(请填写化学式)
(2)b方案中最好用________调节pH。
A.NaOH B.CaO C.NH3·H2O
理由是_____________________________________________________________。
(3)与a、b方案相比,c方案的优点是___________________________________________。
查看答案和解析>>
科目:高中化学 来源:2012届江苏省启东中学高三上学期期中考试化学试卷 题型:填空题
(12分)饮用水中含有一定浓度的NO3一将对人类健康产生危害,NO3一能氧化人体血红蛋白中的Fe(II),使其失去携氧功能。为了降低饮用水中NO3一的浓度,某兴趣小组提出如下方案:
请回答下列问题:
⑴已知过滤后得到的滤渣是一种混合物,则在溶液中铝粉和NO3一反应的离子方程式为
__________________________________________。
⑵该方案中选用熟石灰调节pH,理由是_______________________、__________________,在调节pH时,若pH过大或过小都会造成 的利用率降低。
⑶用H2催化还原法也可降低饮用水中NO3-的浓度,已知反应中的还原产物和氧化产物均可参与大气循环,则催化还原法的离子方程式为____________________________________。
⑷饮用水中的NO3- 主要来自于NH4+。已知在微生物作用的条件下,NH4+ 经过两步反应被氧化成NO3- 。两步反应的能量变化示意图如下:
试写出1 mol NH4+ (aq)全部氧化成NO3- (aq)的热化学方程式是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com