
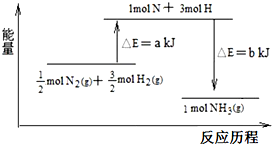
分析 (1)A.根据化学反应的实质以及能量守恒;B.只有自发进行的氧化还原反应才能设计成原电池;C.放热反应发生时不一定要加热,但吸热反应也不一定要加热;D.根据可逆反应的特征分析;
(2)依据反应物和生成物配平书写化学方程式,根据n=$\frac{m}{M}$计算16g液态N2H4物质的量为0.5mol,根据定律关系判断,0.5mol液态N2H4与双氧水充分反应生成氮气和气态水放出320.8kJ热量,所以1mol液态肼完全反应放出641.6KJ的热量,注意物质的聚集状态标注,焓变的正负号和单位;
(3)根据反应热=反应物中的键能之和-生成物中的键能之和求出a.
解答 解:(1)A.化学反应的实质就是旧化学键的断裂,新化学键的形成,在化学反应中,反应物转化为生成物的同时,由于反应物和生成物的能量不等,必然发生能量的变化,故A正确;
B.只有自发进行的氧化还原反应才能设计成原电池,所以不是任何放热反应都能设计成原电池,如酸碱中和反应,故B错误;
C.放热反应发生时不一定要加热,但吸热反应也不一定要加热,故C错误;
D.可逆反应在一定条件下有一定的限度,当反应进行到一定限度后,反应物仍然转化为生成物,故D错误;
故选:A;
(2)16g液态N2H4物质的量为n(N2H4)=$\frac{m}{M}$=$\frac{16g}{32g/mol}$=0.5mol,0.5mol液态N2H4与双氧水充分反应生成氮气和气态水放出320.8kJ热量,所以1mol液态肼完全反应放出641.6KJ的热量,所以热化学反应方程式为:N2H4(l)+2H2O2(l)=N2(g)+4H2O(g)△H=-641.6KJ/mol,
故答案为:N2H4(l)+2H2O2(l)=N2(g)+4H2O(g)△H=-641.6KJ/mol;
(3)该反应放热,反应热=反应物的键能-生成物的键能,氮气和氢气反应生成氨气的热化学方程式为:$\frac{1}{2}$N2(g)+$\frac{3}{2}$H2(g?NH3(g)△H=(a-b)kJ•mol-1,则N2(g)+3H2 (g)=2NH3(g)△H=2(a-b)kJ•mol-1=-184kJ•mol-1,所以a-b=-92,又因b=1219,所以a-b=-92,b=1127,
故答案为:1127.
点评 本题主要考查了化学反应与能量的变化,题目难度不大,注意知识的积累,掌握反应热=反应物的键能-生成物的键能是解答(3)的关键.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
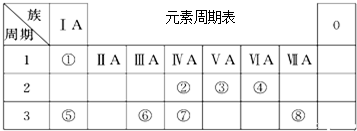
| 元素代号 | 相关信息 |
| A | A的单质能与冷水剧烈反应,得到强碱性溶液 |
| B | B的原子最外层电子数是其内层电子数的三倍 |
| C | 在第3周期元素中,C的离子半径简单最小 |
| D | A、B、D组成的36电子的化合物X是家用消毒剂的主要成分 |
| E | 所有有机物中都含有E元素 |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .?③元素形成的单质的电子式为:
.?③元素形成的单质的电子式为: .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯酚钠溶液中通入过量二氧化碳:2C6H5O-+CO2+H2O→2C6H5OH+CO32- | |
| B. | 溴乙烷的消去反应:C2H5Br+OH-$→_{△}^{水}$C2H4↑+Br-+H2O | |
| C. | 乙醇催化氧化成乙醛:2C2H5OH+O2$→_{△}^{Cu或Ag}$2CH3CHO+2H2O | |
| D. | 乙酸乙酯在碱性条件下水解:CH3COOC2H5+H2O?CH3COOH+C2H5OH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Z为0.3 mol•L-1 | B. | Y2为0.1 mol•L-1 | C. | X2为0.2 mol•L-1 | D. | Z为0.4 mol•L-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com