
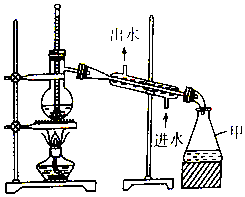
| A. | 仪器甲是锥形瓶,可直接用酒精灯加热 | |
| B. | 温度计水银球应该置于蒸馏烧瓶支管口处 | |
| C. | 直形冷凝管可用球形冷凝管代替 | |
| D. | 石油蒸馏时加沸石,制蒸馏水时不用加沸石 |
分析 A.锥形瓶可间接加热;
B.温度计测定馏分的温度;
C.球形冷凝管冷凝效果要优于直形冷凝管,但球形冷凝管可以存留部分液体,
D.加热液体易发生剧烈沸腾.
解答 解:A.仪器甲是锥形瓶,不能直接用酒精灯加热,故A错误;
B.温度计测定馏分的温度,则温度计水银球应该置于蒸馏烧瓶支管口处,故B正确;
C.球形冷凝管,它的冷凝效果要优于直形冷凝管,但不能用于组装成蒸馏装置,冷凝后的液体残留在球形区域,故C错误;
D.石油蒸馏、制蒸馏水时均需要加沸石,防止暴沸,故D错误;
故选B.
点评 本题考查混合物分离提纯,为高频考点,把握实验装置、实验技能、混合物分离方法为解答的关键,侧重分析与实验能力的考查,注意蒸馏原理的应用,题目难度不大.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 L 0.1 mol/LNaHSO4溶液中含有0.1 NA个HSO4- | |
| B. | 已知反应:5Cl-+ClO3-+6H+=3Cl2+3H2O,每生成71g Cl2,则转移2NA个电子 | |
| C. | 乙烯(C2H4)和环丙烷(C3H6)组成的28g混合气体中含有氢原子数为4NA个 | |
| D. | 标准状况下,22.4LCCl4中含有NA个CCl4分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
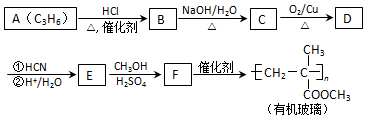
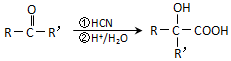 (注:R′可以是烃基,也可以是H原子)
(注:R′可以是烃基,也可以是H原子) )是一种生物可降解材料,参考上述信息设计由乙醇制备聚乳酸的合成路线
)是一种生物可降解材料,参考上述信息设计由乙醇制备聚乳酸的合成路线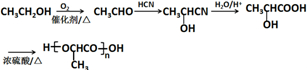 .(示例:反应条件X$\stackrel{反应条件1}{→}$Y$\stackrel{反应条件2}{→}$Z …)
.(示例:反应条件X$\stackrel{反应条件1}{→}$Y$\stackrel{反应条件2}{→}$Z …)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
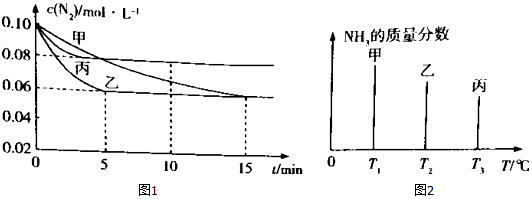
| A. | 图2 中反应速率最快的是容器丙 | |
| B. | 图1 中容器乙的反应可能使用了催化剂 | |
| C. | 图l 中容器乙0~5 min时间内v${\;}_{({N}_{2})}$=0.012mol/(L•min) | |
| D. | 图1 中容器丙内反应的平衡常数为2.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
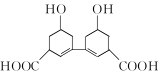
| A. | 分子式为C14H18O6 | B. | 含有羟基、羧基和苯基 | ||
| C. | 能发生取代反应 | D. | 能使溴的水溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com