
【题目】(1)有一包白色固体粉末可能为Na2CO3或NaHCO3其中的一种,请设计实验确定该白色粉末的成分________________________________________;
(2)某同学根据CO32-的性质用纯碱溶液、酚酞试剂、氯化钙溶液,设计了一个探究纯碱溶液呈碱性是由CO32--引起的实验方案,主要实验步骤及实验现象为:
① CO32-水解的离子反应方程式为____________________________________________;
② 取少量氯化钙溶液滴入酚酞,不变红色,说明:_____________________________;
③ 取少量碳酸钠溶液,滴入酚酞后显红色,再加入氯化钙溶液的现象为:____________________________。说明_____________________________________。
【答案】取少量固体于试管中进行加热,将产生的气体通入澄清的石灰水中,观察是否有白色沉淀生成,即可判断原固体是哪一种固体 CO32—+H2O![]() HCO3-+OH— 钙离子和氯离子不会引起溶液显碱性 产生白色沉淀,同时红色变浅,最终褪色 说明Na2CO3溶液碱性是由CO32—引起的
HCO3-+OH— 钙离子和氯离子不会引起溶液显碱性 产生白色沉淀,同时红色变浅,最终褪色 说明Na2CO3溶液碱性是由CO32—引起的
【解析】
(1)碳酸钠与氯化钡反应生成白色沉淀,而碳酸氢钠不能;也可以利用碳酸氢钠的不稳定性鉴别;
(2)碳酸根离子水解使碱性,而加氯化钙,生成白色沉淀,红色变浅,以此说明水解呈碱性;
①CO32-水解以第一步为主;
②氯化钙溶液为中性;
③碳酸钠溶液水解显碱性,加入氯化钙溶液,生成碳酸钙,水解平衡逆向移动,碱性降低。
(1)碳酸钠与氯化钡反应生成白色沉淀,而碳酸氢钠不能,发生的化学反应为Na2CO3+BaCl2═2NaCl+BaCO3↓,设计实验分别取少量溶于水,滴加氯化钡溶液生成白色沉淀的为Na2CO3,无现象的为碳酸氢钠;
或:取少量固体于试管中进行加热,将产生的气体通入澄清的石灰水中,观察是否有白色沉淀生成,即可判断原固体是哪一种固体。
(2)碳酸根离子水解使碱性,而加氯化钙,生成白色沉淀,红色变浅,以此说明水解呈碱性,所以实验步骤及实验现象为:用试管取少量碳酸钠溶液,滴入酚酞呈红色,再向溶液中滴入氯化钙溶液,产生白色沉淀,红色变浅并褪去,此时Na+仍存在于溶液中,说明溶液的碱性由CO32-引起,
①CO32-水解的离子反应方程式为:CO32—+H2O![]() HCO3-+OH—;
HCO3-+OH—;
②取少量氯化钙溶液滴入酚酞,不变红色,说明溶液不显碱性,证明:钙离子和氯离子不会引起溶液显碱性;
③取少量碳酸钠溶液,滴入酚酞后显红色,再加入氯化钙溶液的现象为产生白色沉淀,红色变浅并褪去,说明纯碱溶液呈碱性是由CO32-引起。


科目:高中化学 来源: 题型:
【题目】中国科学家用蘸墨汁书写后的纸张作为空气电极,设计并组装了轻型、柔性、能折叠的可充电锂空气电池如图甲,电池的工作原理如图乙。下列有关说法正确的是

A. 放电时,纸张中的纤维素作为锂电池的负极
B. 充电时,若阳极放出1molO2,则有4mol e-回到电源正极
C. 开关K闭合给锂电池充电,X对应充电电极上的反应为Li++e-=Li
D. 放电时,Li+由正极经过有机电解质溶液移向负极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】直接排放含SO2的烟气会形成酸雨,危害环境。利用钠碱循环法可脱除烟气中的SO2。
(1)用化学方程式表示SO2形成硫酸型酸雨的反应:______________。
(2)在钠碱循环法中,Na2SO3溶液作为吸收液,可由NaOH溶液吸收SO2制得,该反应的离子方程式是________________________
(3)吸收液吸收SO2的过程中,pH随n(SO3﹣):n(HSO3﹣)变化关系如下表:
n(SO﹣):n(HSO﹣) | 91:9 | 1:1 | 1:91 |
pH | 8.2 | 7.2 | 6.2 |
①上表判断NaHSO3溶液显______性,用化学平衡原理解释:____________
②当吸收液呈中性时,溶液中离子浓度关系正确的是(选填字母):____________
a.c(Na+)=2c(SO32-)+c(HSO3-),
b.c(Na+)> c(HSO3-)> c(SO32-)>c(H+)=c(OH-)
c.c(Na+)+c(H+)= c(SO32-)+ c(HSO3-)+c(OH-)
(4)当吸收液的pH降至约为6时,需送至电解槽再生。再生示意图如下:
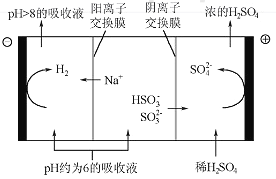
①HSO3-在阳极放电的电极反应式是_______________。
②当阴极室中溶液pH升至8以上时,吸收液再生并循环利用。简述再生原理:__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】秦皮是一种常用的中药,具有抗炎镇痛、抗肿瘤等作用。“秦皮素”是其含有的一种有效成分,结构简式如图所示,有关其性质叙述不正确的是( )

A.该有机物分子式为C10H8O5
B.分子中有四种官能团
C.该有机物能发生加成、氧化、取代等反应
D.1mol该化合物最多能与3molNaOH反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图所示装置,以NH3作氢源,可实现电化学氢化反应。下列说法错误的是

A.a为阴极
B.b电极反应为:2NH3-6e-=N2+6H+
C.电解一段时间后,装置内H+数目增多
D.理论上每消耗1 mol NH3,可生成1.5mol![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E是原子序数依次增大的五种常见元素,其中A是原子半径最小的元素,B元素的一种核素可用于考古断代,D元素的s轨道和p轨道上的电子数相等且有2个未成对电子;E是第四周期元素,其原子核外最外层电子数与A原子相同,其余各层电子均充满。请用元素符号或化学式回答下列问题:
(1)A、B、C、D四种元素中,电负性最大的是___,第一电离能最大的是___。
(2)化合物CA3的沸点比化合物BA4的高,其主要原因是____。
(3)A、B形成的化合物M与氢氰酸(HCN)反应可得丙烯腈(H2C=CH—C≡N),则M的结构式为___,丙烯腈分子中碳原子轨道杂化类型是____。
(4)由C元素形成的一种离子与BD2互为等电子体,该离子的结构式为____。
(5)基态E原子的核外电子排布式为____,如图是D、E形成的某种化合物的晶胞结构示意图,该晶体的化学式为____。

(6)向E的硫酸盐溶液中通入过量的CA3,可生成[E(CA3)4]2+,1mol[E(CA3)4]2+中含有σ键的数目约为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】葡萄是一种常见水果,可以生食或制作葡萄干,除此之外,葡萄还可用于酿酒。
(1)检验葡萄汁含有葡萄糖的方法是:向其中加碱调至碱性,再加入新制的Cu(OH)2并加热,其现象是________。
(2)葡萄在酿酒过程中,葡萄糖转化为酒精的过程如下,补充完成下列化学方程式:C6H12O6(葡萄糖)![]() 2_________+ 2 C2H5OH
2_________+ 2 C2H5OH
(3)葡萄酒密封储存过程中会生成有香味的酯类,酯类也可以通过化学实验来制备,实验室可用如图所示装置制备乙酸乙酯:

①试管a中生成乙酸乙酯的化学方程式是__________。
②试管b中盛放的试剂是饱和____________溶液。
③实验开始时,试管b中的导管不伸入液面下的原因是________。
④若要分离出试管b中的乙酸乙酯,需要用到的仪器是_______(填字母)。
A.普通漏斗 B.分液漏斗 C.长颈漏斗
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W为四种常见的短周期元素。其中Y元素原子核外最外层电子数是其电子层数的3倍,它们在周期表中的相对位置如图所示:
X | Y | |
Z | W |
请回答以下问题:
(1)W在周期表中位置___;
(2)X和氢能够构成+1价阳离子,其电子式是___,Y的气态氢化物比Z的气态氢化物的沸点高,缘故是___;
(3)X的最高价氧化物的水化物与其氢化物能化合生成M,M的晶体类型为___,M的水溶液显酸性的缘故是___(用离子方程式表示)。
(4)①Y和Z可组成一种气态化合物Q,Q能与W的单质在潮湿环境中反应,反应的化学方程式是___。
②在一定条件下,化合物Q与Y的单质反应达平衡时有三种气态物质,反应时,每转移4mol电子放热190.0kJ,该反应的热化学方程式是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答下列问题:
![]() 用浓硫酸给竹筒“刻字”是利用浓硫酸的______性。
用浓硫酸给竹筒“刻字”是利用浓硫酸的______性。
![]() 生产硅酸盐产品水泥和玻璃都需要用到的原料是______。
生产硅酸盐产品水泥和玻璃都需要用到的原料是______。
![]() 从石油中获得汽油、柴油、煤油等燃料,可用______方法分离。
从石油中获得汽油、柴油、煤油等燃料,可用______方法分离。
![]() 清晨,在茂密的树林中,常常可以看到从枝叶间透过的一道道光柱,这种现象在化学上可称为______。
清晨,在茂密的树林中,常常可以看到从枝叶间透过的一道道光柱,这种现象在化学上可称为______。
![]() 溴和碘及其化合物在生产生活中具有广泛的应用,如______可用于人工降雨。
溴和碘及其化合物在生产生活中具有广泛的应用,如______可用于人工降雨。
![]() 、
、![]() 、
、![]() 三者质量之比为1:2:5,则它们的氧原子数之比为______。
三者质量之比为1:2:5,则它们的氧原子数之比为______。
![]() 某金属氯化物
某金属氯化物![]() 中含有
中含有![]() ,则
,则![]() 的摩尔质量为______。
的摩尔质量为______。
![]() 高岭石化学式为
高岭石化学式为![]() ,将其改写成氧化物形式的化学式为______。
,将其改写成氧化物形式的化学式为______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com