

分析 (1)①该仪器是圆底烧瓶.
②根据气体的溶解性、密度选取合适的收集方法.
③利用图Ⅰ装置制备并收集干燥的NO2气体,干燥二氧化氮气体需要酸性干燥剂;
④铜和稀硝酸反应生成硝酸铜、一氧化氮和水;
(2)①反应前后元素的化合价升高的物质是还原剂,还原剂具有还原性.
②氨气和氧气在一定条件下反应生成一氧化氮和水,一氧化氮和氧气能反应生成二氧化氮.
解答 解:(1)①该仪器是圆底烧瓶.
故答案为:圆底烧瓶.
②二氧化氮气体易溶于水,所以不能用排水法收集;二氧化氮的密度大于空气的密度且和氧气不反应,所以可以采用向上排空气法收集.
故答案为:瓶口向上排空气法收集.
③利用图Ⅰ装置制备并收集干燥的NO2气体,干燥二氧化氮气体需要酸性干燥剂,固体干燥剂为P2O5,
故答案为:P2O5;
④铜和稀硝酸反应生成硝酸铜、一氧化氮和水,离子方程式为:3Cu+8H++2NO3-=3Cu2++4H2O+2NO↑.
故答案为:3Cu+8H++2NO3-=3Cu2++4H2O+2NO↑;
(2)①氨气中氮元素的化合价是-3价,二氧化氮中氮元素的化合价是+4价,反应前后氮元素的化合价升高,所以氨气作还原剂,体现其还原性.
故答案为:还原性.
②氨气和氧气在一定条件下反应生成一氧化氮和水,一氧化氮和氧气能反应生成二氧化氮,反应方程式为:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O,2NO+O2=2NO2.
故答案为:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O;2NO+O2=2NO2.
点评 本题考查了氮及其化合物的性质,难度中等,会根据气体的溶解性、密度选取合适的收集方法.


 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:解答题
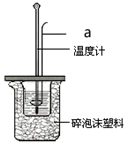 利用50mL 0.50mol•L-1盐酸、50mL 0.55mol•L-1 NaOH溶液,在如图所示装置中测定中和热,回答下列问题:
利用50mL 0.50mol•L-1盐酸、50mL 0.55mol•L-1 NaOH溶液,在如图所示装置中测定中和热,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1L 1 mol/L CH3COONa溶液中存在NA个CH3COO- | |
| B. | 标况下,22.4L 甲醇中所含原子数一定为6NA | |
| C. | 1mol CnH2n+2含有(3 n+1)NA个共价键 | |
| D. | 0.1mol羟基含有的电子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
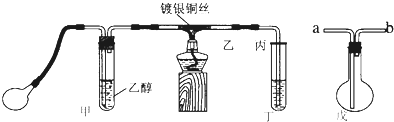
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
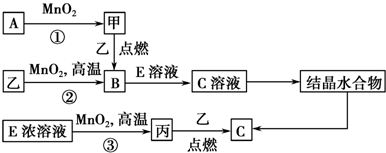
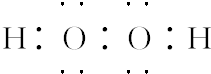 .若反应①需在加热条件下进行,则反应①的化学方程式为2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2↑.
.若反应①需在加热条件下进行,则反应①的化学方程式为2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2↑.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com