
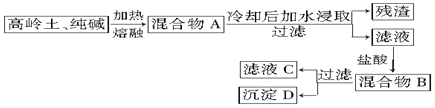
·ÖĪö ±¾ĢāĢ½¾æµÄŹĒĄūÓĆøßĮėĶĮ[ĘäÖ÷ŅŖ³É·ÖŹĒAl2O3•2SiO2•2H2O]ŗĶ“æ¼īĪŖŌĮĻÖĘŠĀŠĶ¾»Ė®¼ĮµÄĮ÷³Ģ£¬øł¾ŻĮ÷³ĢæÉÖŖ»ģŗĻĪļŌŚ¼ÓČČČŪČŚµÄ¹ż³ĢÖŠÉś³ÉĮĖ¹čĖįÄĘŗĶĘ«ĀĮĖįÄĘ£¬¼ÓĖ®Čܽāŗó¹żĀĖ³żČ„²»ČÜĪļ£¬ĀĖŅŗÖŠ¼Ó×ćĮæŃĪĖįµĆµ½³Įµķ¹čĖį£¬¹żĀĖŗóµÄČÜŅŗÖŠŗ¬AlCl3£¬
£Ø1£©ÓÉ·ÖĪöæÉÖŖ£¬AŹĒ“æ¼īÓėAl2O3ŗĶSiO2ŌŚČŪȌדĢ¬Éś³ÉµÄ²śĪļ£¬A¼ÓĖ®Čܽā¹żĀĖ³żČ„²»ČÜĪļŗóµĆµ½AÖŠæÉČÜŠŌŃĪČÜŅŗµÄ»ģŗĻĪļ£¬µĪ¼Ó¹żĮæŃĪĖįŗó»įÉś³É¹čĖį³ĮµķŗĶĀČ»ÆĀĮČÜŅŗ£»
£Ø2£©øł¾ŻĢāÄæĖłĢįŹ¾µÄŠÅĻ¢¼°½įŗĻ¹čĖįŃĪ¹¤ŅµĄķĀŪ£¬ŹéŠ“»Æѧ·½³ĢŹ½£»
£Ø3£©ĖłŃ”ŌńµÄŅĒĘ÷²»ÄÜŗĶČŪČŚøßĮėĶĮ¼°“æ¼īŹŌŃł·¢Éś·“Ó¦£®
½ā“š ½ā£ŗ£Ø1£©Ńõ»ÆĀĮŗĶ¶žŃõ»Æ¹čŌŚøßĪĀČŪȌדĢ¬ĻĀÓė“æ¼ī·“Ӧɜ³ÉA³É·ÖĪŖ¹čĖįÄĘŗĶĘ«ĀĮĖįÄĘ£¬AÖŠ¼ÓĖ®Čܽā²¢¹żĀĖŗóµĆµ½µÄÖ÷ŅŖŹĒ¹čĖįÄĘÓėĘ«ĀĮĖįÄʵĻģŗĻŅŗ£¬AĪŖNaAlO2ŗĶNa2SiO3 £¬µĪ¼Ó¹żĮæŃĪĖį»įÉś³É¹čĖį³ĮµķŗĶĀČ»ÆĀĮČÜŅŗ£¬BĪŖAlCl3ŗĶH2SiO3µÄ»ģŗĻĪļ£¬¹żĀĖŗóµÄ²»ČÜĪļ³ĮµķDĪŖH2SiO3£¬ĀĖŅŗCĪŖAlCl3ČÜŅŗ£¬
¹Ź“š°øĪŖ£ŗNaAlO2ŗĶNa2SiO3£»AlCl3ŗĶH2SiO3£»AlCl3£»H2SiO3£»
£Ø2£©Ńõ»ÆĀĮŅŌ¼°¶žŃõ»Æ¹čÓėĢ¼ĖįÄʵķ“Ó¦ĪŖ£ŗNa2CO3+Al2O3$\frac{\underline{\;øßĪĀ\;}}{\;}$2NaAlO2+CO2”ü”¢Na2CO3+SiO2$\frac{\underline{\;øßĪĀ\;}}{\;}$Na2SiO3+CO2”ü£¬
¹Ź“š°øĪŖ£ŗNa2CO3+Al2O3$\frac{\underline{\;øßĪĀ\;}}{\;}$2NaAlO2+CO2”ü”¢Na2CO3+SiO2$\frac{\underline{\;øßĪĀ\;}}{\;}$Na2SiO3+CO2”ü£»
£Ø3£©“ÉŪįŪö”¢²£Į§ŪįŪöµÄ³É·ÖÖŠŗ¬ÓŠ¶žŃõ»Æ¹č£¬ÄÜŗĶ“æ¼ī·¢Éś·“Ó¦£¬Ńõ»ÆĀĮŪįŪöŅ²ÄÜŗĶ“æ¼ī·¢Éś·“Ó¦£¬ŌŚ¼ÓČČŹ±·“Ó¦Ņ׏¹ŪįŪöÕØĮŃ£¬ŌņӦєŌńĢśŪįŪö£¬
¹Ź“š°øĪŖ£ŗD£®
µćĘĄ ±¾Ģāæ¼²éŗ¬¹čŌŖĖŲµÄ»ÆŗĻĪļµÄŠŌÖŹ£¬Ö÷ŅŖŹĒ¹č¼°Ęä»ÆŗĻĪļŠŌÖŹŗĶ×Ŗ»ÆµÄ·ÖĪöÅŠ¶Ļ£¬æÉŅŌøł¾ŻĖłŃ§ÖŖŹ¶½ųŠŠ»Ų“š£¬ĢāÄæÄѶČÖŠµČ£®


 ¾ŁŅ»·“ČżĶ¬²½Ēɽ²¾«Į·ĻµĮŠ“š°ø
¾ŁŅ»·“ČżĶ¬²½Ēɽ²¾«Į·ĻµĮŠ“š°ø æŚĖćÓėÓ¦ÓĆĢāæØĻµĮŠ“š°ø
æŚĖćÓėÓ¦ÓĆĢāæØĻµĮŠ“š°ø ĆūŹ¦µć¾¦×Ö“Ź¾ä¶ĪĘŖĻµĮŠ“š°ø
ĆūŹ¦µć¾¦×Ö“Ź¾ä¶ĪĘŖĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | .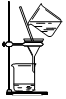 ×°ÖĆæÉÓĆÓŚ³żČ„ŅŅ“¼ÖŠµÄäå±½ | |
| B£® | .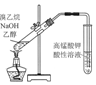 ÓĆĶ¼ĖłŹ¾×°ÖĆ¼ģŃéäåŅŅĶéÓėNaOH“¼ČÜŅŗ¹²ČČ²śÉśµÄC2H4 | |
| C£® | .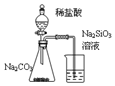 ×°ÖĆæÉÖ¤Ć÷·Ē½šŹōŠŌCl£¾C£¾Si | |
| D£® | 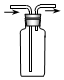 ×°ÖĆæÉÓĆÓŚŹÕ¼ÆO2 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ¶ąŃ”Ģā
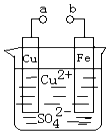
| A£® | aŗĶb²»Į¬½ÓŹ±£¬ĢśĘ¬ÉĻ»įÓŠ½šŹōĶĪö³ö | |
| B£® | aŗĶbÓƵ¼ĻßĮ¬½ÓŹ±£¬ĢśĘ¬ÉĻ·¢ÉśµÄ·“Ó¦ĪŖ£ŗFe-3e-ØTFe3+ | |
| C£® | ĪŽĀŪaŗĶbŹĒ·ńĮ¬½Ó£¬ĢśĘ¬¾ł»įČܽā£¬ČÜŅŗ“ÓĄ¶É«Öš½„±ä³ÉĒ³ĀĢÉ« | |
| D£® | aŗĶbÓƵ¼ĻßĮ¬½Óŗó£¬ĢśĘ¬ÉĻ·¢Éś»¹Ō·“Ó¦£¬ČÜŅŗÖŠĶĄė×ÓĻņĶµē¼«ŅĘ¶Æ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | Ąė×Ó°ė¾¶£ŗŅõĄė×Ó£¾ŃōĄė×Ó | B£® | ĖįŠŌ£ŗHClO4£¾H2SO4 | ||
| C£® | ČŪ·Šµć£ŗ¹²¼Ū»ÆŗĻĪļ£¾Ąė×Ó»ÆŗĻĪļ | D£® | ĪČ¶ØŠŌ£ŗPH3£¾NH3 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
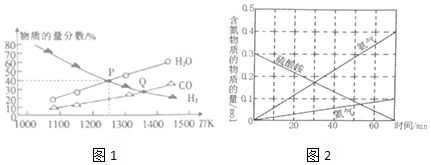
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
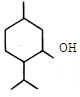
| A£® | X·Ö×ÓŹ½ĪŖC10H20O£¬ĖüŹĒ»·¼ŗ“¼µÄĶ¬ĻµĪļ | |
| B£® | X·Ö×Ó»·ÉĻµÄŅ»ĀČČ”“śĪļÖ»ÓŠČżÖÖ | |
| C£® | X·Ö×ÓÖŠÖĮÉŁÓŠ12øöŌ×ÓŌŚĶ¬Ņ»Ę½ĆęÉĻ | |
| D£® | ŌŚŅ»¶ØĢõ¼žĻĀ£¬XÄÜ·¢ÉśČ”“ś·“Ó¦”¢Ńõ»Æ·“Ó¦”¢¾ŪŗĻ·“Ó¦ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
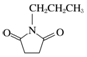 µÄŗĻ³ÉĀ·ĻßĮ÷³ĢĶ¼£ØĪŽ»śŹŌ¼ĮČĪŃ”£©£®ŗĻ³ÉĀ·ĻßĮ÷³ĢĶ¼Ź¾ĄżČēĻĀ£ŗ
µÄŗĻ³ÉĀ·ĻßĮ÷³ĢĶ¼£ØĪŽ»śŹŌ¼ĮČĪŃ”£©£®ŗĻ³ÉĀ·ĻßĮ÷³ĢĶ¼Ź¾ĄżČēĻĀ£ŗ²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | $\frac{n}{A+16}$£ØA-N+8£©mol | B£® | $\frac{n}{A+16}$£ØA-N+10£©mol | C£® | $\frac{n}{A}$ £ØA-N+2£©mol | D£® | $\frac{n}{A}$£ØA-N+6£©mol |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
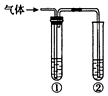 ÓĆĻĀĶ¼×°ÖĆĶź³ÉĻĀĮŠŹµŃ飬²»ŠčŅŖŹŌ¹Ü¢Ł£ØÄŚŹ¢ÓŠĻąÓ¦µÄ³żŌÓŹŌ¼Į£©¾ĶÄÜ“ļµ½ŹµŃéÄæµÄŹĒ£Ø””””£©
ÓĆĻĀĶ¼×°ÖĆĶź³ÉĻĀĮŠŹµŃ飬²»ŠčŅŖŹŌ¹Ü¢Ł£ØÄŚŹ¢ÓŠĻąÓ¦µÄ³żŌÓŹŌ¼Į£©¾ĶÄÜ“ļµ½ŹµŃéÄæµÄŹĒ£Ø””””£© | ŹµŃéÄæµÄ | ¢ŚÖŠµÄŹŌ¼Į | |
| A | ¼ģŃéĢ¼ÓėÅØĮņĖį·“Ó¦²śÉśµÄĘųĢåÖŠŗ¬ÓŠ¶žŃõ»ÆĢ¼ | ³ĪĒåŹÆ»ŅĖ® |
| B | ÓĆĢ¼ĖįøĘÓėŃĪĖį·“Ó¦²śÉśµÄĘųĢåŃéÖ¤Ģ¼ĖįµÄĖįŠŌĒæÓŚ±½·Ó | ±½·ÓÄĘČÜŅŗ |
| C | ŃéÖ¤ŅŅ“¼ŌŚÅØĮņĖį×÷ÓĆĻĀ·¢ÉśĻūČ„·“Ó¦²śÉśµÄĘųĢåĪŖ²»±„ŗĶĢž | ĖįŠŌøßĆĢĖį¼ŲČÜŅŗ |
| D | ŃéÖ¤ŹÆĄÆÓĶŌŚĖé“ÉʬÉĻŹÜČČ·Ö½ā²śÉśµÄĘųĢåÖŠŗ¬ÓŠ²»±„ŗĶĢž | äåµÄĖÄĀČ»ÆĢ¼ČÜŅŗ |
| A£® | A | B£® | B | C£® | C | D£® | D |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com