
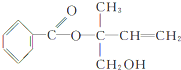 ,则下列有关说法正确的是( )
,则下列有关说法正确的是( )| A. | X的分子式为C12H16O3 | |
| B. | X在一定条件下能发生加成、加聚、取代、消去等反应 | |
| C. | 可用酸性高锰酸钾溶液区分苯和X | |
| D. | 在Ni作催化剂的条件下,1molX最多只能与1molH2加成 |
分析 有机物含有酯基,可发生水解反应,含有碳碳双键,可发生加成、加聚和氧化反应,含有羟基,可发生取代、消去和氧化反应,以此解答该题.
解答 解:A.由有机物结构简式可知有机物分子式为C12H14O3,故A错误;
B.能发生消去反应的羟基,但羟基邻位碳原子不含氢原子,则不能发生消去反应,故B错误;
C.X含有碳碳双键,可与酸性高锰酸钾发生氧化还原反应,可用于区别苯,故C正确;
D.能与氢气发生加成反应的为苯环和碳碳双键,则1mol X最多只能与4mol H2加成,故D错误.
故选C.
点评 本题考查有机物的结构和性质,为高考常见题型,侧重于学生的分析能力的考查,注意把握有机物的结构特点和官能团的性质,为解答该题的关键,难度不大.


科目:高中化学 来源: 题型:解答题
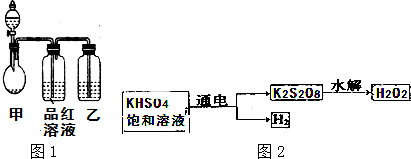
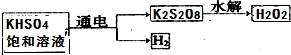
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 物 质 | 杂 质 | 试剂 | 提 纯 方 法 | |
| A | BaSO4 | BaCO3 | 水 | 溶解、过滤、洗涤 |
| B | CO2 | SO2 | 饱和Na2CO3溶液 | 洗气 |
| C | 乙酸乙酯 | 乙酸 | 稀NaOH溶液 | 混合振荡、静置分液 |
| D | 蛋白质 | 葡萄糖 | 浓(NH4)2SO4溶液 | 溶解、过滤、洗涤 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2NO2((g)+O3(g)?N2O5(g)+O2(g)中N2O5既是氧化产物又是还原产物 | |
| B. | aA(s)+bB(g)=cC(g),若将容器体积增至原来2倍,C浓度降至原来的0.5倍,则a+b=c | |
| C. | 对于2SO2(g)+O2(g)?2SO3(g)的平衡体系,在温度、压强保持不变时充入少量SO3,则正反应速率减小、逆反应速率增大,平衡向逆反应方向移动 | |
| D. | 对于N2(g)+3H2(g)?2NH3(g)△H的平衡体系,仅将所有物质浓度加倍,平衡将向正反应方向移动,但△H不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
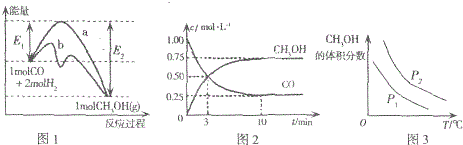
| A. | 图1中曲线b表示使用了催化剂;该反应属于放热反应 | |
| B. | 当压强不同(P1<P2)时,平衡时甲醇的体积分数随温度变化的曲线如图3 | |
| C. | 一定温度下,容器中压强恒定时该反应已达平衡状态 | |
| D. | 该温度下CO(g)+2H2(g)?CH3OH(g)的化学平衡常数为10 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 弱酸 | H2CO3 | 水杨酸(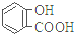 ) ) |
| 电离平衡常数(25℃) | Ka1=4.3×10-7 Ka2=5.6×10-11 | Ka1=1.3×10-3 Ka2=1.1×10-13 |
| A. | 常温下,等浓度、等体积的NaHCO3 溶液pH小于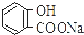 溶液pH 溶液pH | |
| B. | 常温下,等浓度、等体积的Na2 CO3 溶液和 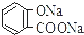 溶液中所含离子总数前者小于后者 溶液中所含离子总数前者小于后者 | |
| C. | 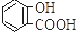 +2NaHCO3→ +2NaHCO3→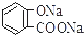 +2H2O+2CO2↑ +2H2O+2CO2↑ | |
| D. | 水杨酸的第二级电离 Ka2 远小于第一级电离Ka1 的原因之一是 能形成分子内氢键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | P既是氧化剂又是还原剂,CuSO4只是还原剂 | |
| B. | 若有11molP参加反应,转移电子的物质的量为60mol | |
| C. | 1molCuSO4可以氧化$\frac{1}{5}$molP | |
| D. | Cu3P既是氧化产物又是还原产物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 淀粉和纤维素互为同分异构体 | |
| B. | 糖类、油脂和蛋白质是基本营养物质,它们都是天然高分子化合物 | |
| C. | 可以用溴水鉴别苯、CCl4和无水乙醇 | |
| D. | 苯可以发生取代反应和加成反应,但是无法发生氧化反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com