
(本题12分)某化学科研小组研究在其他条件不变时,改变某一反应条件对反应[可用aA(g)+bB(g)  cC(g)表示]化学平衡的影响,得到如下图象(图中p表示压强,T表示温度,n表示物质的量,α表示平衡转化率,φ表示体积分数):
cC(g)表示]化学平衡的影响,得到如下图象(图中p表示压强,T表示温度,n表示物质的量,α表示平衡转化率,φ表示体积分数):

(1)在反应Ⅰ中,若p1>p2,则此正反应为 (填“吸热”或“放热”)反应,也是一个气体分子数 (填“减小”或“增大”)的反应。由此判断,此反应自发进行必须满足的条件是 。
(2)在反应Ⅱ中,T1 T2(填“>”、“<”或“=”),该正反应为 (填“吸热”或“放热”)反应。
(3)在反应Ⅲ中,若T2>T1,则此正反应为 (填“吸热”或“放热”)反应。
(4)反应Ⅳ中,若T1>T2,则该反应能否自发进行? 。
科目:高中化学 来源:2014-2015学年河南省八市高三教学质量监测考试理科综合化学试卷(解析版) 题型:填空题
选考【化学——选修5,有机化学基础】(15分)高聚酚酯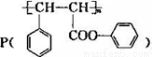 是一种环保型的新涂料,其合成路线如下图所示:’
是一种环保型的新涂料,其合成路线如下图所示:’
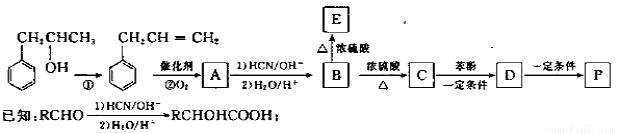
请回答下列问题:
(1)P的分子式为________,反应①属于________反应,反应①还有多种有机副产物,其中能使溴的CCl4溶液褪色的副产物的结构筒式为________。
(2)若反应②中两种反应物物质的量之比为1:1,则除A外另一种产物的名称是________,E是高分子化台物,其结构筒式为________。
(3)C转化为D的化学方程式是______________________.
(4)B有多种同分异构体,符舍下列条件的同分异构体共有_____种,其中校磁共振氢谱中有6组峰的是_________(写出其中一种的结构简式)。
①能与NaHCO3 溶液反应
②遇3溶液显紫色
③分子中含一个-CH3
(5)由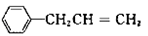 合成B的另一种途径为
合成B的另一种途径为

则F中官能团名称是_________,H的结构简式为_________,试剂G的化学式_________。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省南京市、盐城市高三第二次模拟考试化学试卷(解析版) 题型:填空题
(12分)碱式次氯酸镁[Mga(ClO)b(OH)c·xH2O]是一种有开发价值的微溶于水的无机抗菌剂。为确定碱式次氯酸镁的组成,进行如下实验:
①准确称取1.685 g碱式次氯酸镁试样于250 mL锥形瓶中,加入过量的KI溶液,用足量乙酸酸化,用0.800 0 mol·L-1的Na2S2O3标准溶液滴定至终点(离子方程式为2S2O32-+I2===2I-+S4O ),消耗25.00 mL。
),消耗25.00 mL。
②另取1.685 g碱式次氯酸镁试样,用足量乙酸酸化,再用足量3%H2O2溶液处理至不再产生气泡(H2O2被ClO-氧化为O2),稀释至1 000 mL。移取25.00 mL溶液至锥形瓶中,在一定条件下用0.020 00 mol·L-1的EDTA(Na2H2Y)标准溶液滴定其中的Mg2+(离子方程式为Mg2++H2Y2-===MgY2-+2H+),消耗25.00 mL。
(1)步骤①需要用到的指示剂是________。
(2)步骤②若滴定管在使用前未用EDTA标准溶液润洗,测得的Mg2+物质的量将________(填“偏高”“偏低”或“不变”)。
(3)通过计算确定碱式次氯酸镁的化学式(写出计算过程)。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省南京市、盐城市高三第二次模拟考试化学试卷(解析版) 题型:选择题
国务院办公厅2014年5月印发了《2014~2015年节能减排低碳发展行动方案》。下列做法违背低碳发展原则的是
A.发展氢能和太阳能
B.限制塑料制品的使用
C.提高原子利用率,发展绿色化学
D.尽量用纯液态有机物代替水作溶剂
查看答案和解析>>
科目:高中化学 来源:2014-2015学年天津市河北区高三总复习质量检测一化学试卷(解析版) 题型:选择题
下述转化关系可用于合成解痉药奥昔布宁的前体(化合物丙)。
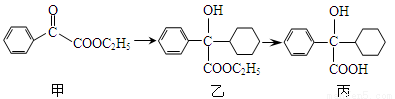
下列说法正确的是
A.化合物甲的分子式为C10H10O3,分子中的含氧官能团有醛基和酯基
B.化合物乙能发生消去反应,且生成的有机物能和溴发生加成反应
C.化合物乙与NaOH水溶液在加热条件下反应生成化合物丙
D.化合物丙能和氯化铁溶液发生显色反应
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省达州市高三3月月考化学试卷(解析版) 题型:选择题
“绿色化学实验”已走进课堂,下列做法符合“绿色化学”的是

①实验室收集氨气采用图一所示装置
②实验室中做氯气与钠反应实验时采用图二所示装置
③实验室中用玻璃棒分别蘸取浓盐酸和浓氨水做氨气与酸生成铵盐的实验
④实验室中采用图三所示装置进行铜与稀硝酸的反应
A.②③④ B.①②③ C.①②④ D.①③④
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖南省常德市高三模拟考试理综化学试卷(解析版) 题型:填空题
目前半导体生产展开了一场“铜芯片”革命——在硅芯片上用铜代替铝布线,古老的金属铜在现代科技应用上取得了突破,用黄铜矿(主要成分为CuFeS2)生产粗铜,其反应原理如下:

回答下列问题:
(1)基态铜原子的电子排布式为 ,硫、氧元素相比,第一电离能较小的元素是 (填元素符号)。
(2)反应①、②中均生成有相同的气体分子,该分子的中心原子杂化类型是 ,其立体结构是 。
(3)某学生用硫酸铜溶液与氨水做了一组实验:CuSO4溶液 蓝色沉淀
蓝色沉淀 沉淀溶解,得到深蓝色透明溶液。写出蓝色沉淀溶于氨水的离子方程式 ;深蓝色透明溶液中的阳离子(不考虑H+)内存在的全部化学键类型有 。
沉淀溶解,得到深蓝色透明溶液。写出蓝色沉淀溶于氨水的离子方程式 ;深蓝色透明溶液中的阳离子(不考虑H+)内存在的全部化学键类型有 。
(4)铜是第四周期最重要的过渡元素之一,其单质及化合物具有广泛用途,铜晶体中铜原子堆积模型为 ;铜的某种氧化物晶胞结构如图所示,若该晶体的密度为d g/cm3,阿伏加德罗常数的值为NA,则该晶胞中铜原子与氧原子之间的距离为 pm。(用含d和NA的式子表示)。
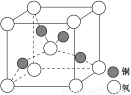
查看答案和解析>>
科目:高中化学 来源:2014-2015学年内蒙古鄂尔多斯市高三模拟化学试卷(解析版) 题型:填空题
(14分)(1)工业上可利用“甲烷蒸气转化法”生产氢气,反应为甲烷和水蒸气在高温和催化剂存在的条件下生成一氧化碳和氢气,有关反应的能量变化如图1:
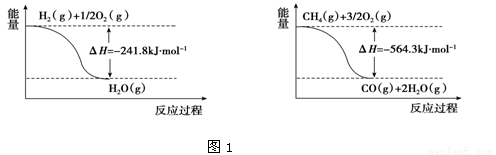
则该反应的热化学方程式_____________________________________。
(2)已知温度、压强对甲烷平衡含量的影响如图2,请回答:
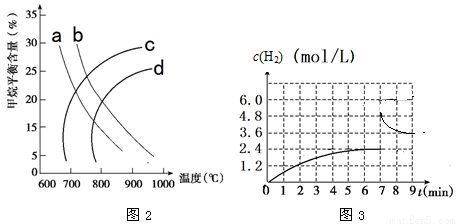
①图26-2中a、b、c、d四条曲线中的两条代表压强分别为1Mpa、2Mpa时甲烷含量曲线,其中表示1Mpa的是________。
②该反应的平衡常数:600 ℃时________700 ℃(填“>”“<”或“=”)。
③已知:在700 ℃,1 MPa时,1 mol CH4与1 mol H2O在1 L的密闭容器中反应,6min达到平衡(如图3),此时CH4的转化率为________________,该温度下反应的平衡常数为______________(结果保留小数点后一位数字)。
④从图3分析,由第一次平衡到第二次平衡,平衡移动的方向是_____________(填“向正反应方向”或“向逆反应方向”),采取的措施可能是_____________________。
(3)以N2、H2为电极反应物,以HCl-NH4Cl为电解质溶液制造新型燃料电池,放电过程中,溶液中铵根离子浓度逐渐增大。写出该电池的正极反应式:_________________。
查看答案和解析>>
科目:高中化学 来源:2014-2015四川省达州市高二3月月考化学试卷(解析版) 题型:选择题
常温时,pH值为3的CH3COOH和pH为11的NaOH溶液等体积混合,混合后溶液pH为
A.pH>7 B.pH<7 C.pH=7 D.无法判断
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com