
| A. | 加热蒸馏 | |
| B. | 先加入烧碱溶液,之后蒸馏出乙醛;再加入浓硫酸,蒸馏出乙酸 | |
| C. | 加入Na2CO3后,通过萃取的方法分离 | |
| D. | 利用银镜反应进行分离 |
分析 CH3CHO、CH3COOH均溶于水,二者均易挥发,沸点不同,选择蒸馏法分离,为充分分离,可加入碳酸盐,然后加入硫酸,以此来解答.
解答 解:A.均易挥发,直接加热蒸馏不能得到纯净物,故A不选;
B.先加入烧碱溶液,乙酸与NaOH反应增大与乙醛的沸点差异,蒸馏先蒸出乙醛,再加入浓H2SO4,与乙酸钠反应生成乙酸,然后蒸出乙酸,故B选;
C.乙酸与碳酸钠反应后,与乙醛混溶,不能萃取分离,故C不选;
D.乙醛发生银镜反应生成乙酸,但银氨溶液呈碱性,生成乙酸铵,引入稀杂质,故D不选.
故选B.
点评 本题考查物质分离提纯方法的选择和应用,为高频考点,把握物质的性质、性质差异及混合物分离原理为解答的关键,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | ①⑤⑥⑨ | B. | ④⑥⑦⑧ | C. | ④⑥⑦⑨ | D. | ③④⑥⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 纸层析法中的展开剂之所以能够展开的主要原理是毛细现象 | |
| B. | 抽滤时,滤纸要小于布氏漏斗 | |
| C. | 萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大 | |
| D. | 测定溶液pH的操作:将pH试纸置于表面皿上,用洁净玻璃棒蘸取溶液,点在pH试纸的中部,与对应的标准比色卡比较 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.0L 0.1mol/L的NH4Cl溶液中NH4+的个数为0.1NA | |
| B. | 常温下,Cu-Zn原电池中,正极产生1.12LH2时,转移的电子数为0.1NA | |
| C. | 常温下,0.05mol CO2和SO2混合气体中所含氧原子数为0.1NA | |
| D. | 高温高压下,1.4 g N2与0.3 g H2反应,生成的NH3分子数为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 键能的大小可以衡量化学键的强弱,也可以用于估算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差.参考以下表格的键能数据,回答下列问题:
键能的大小可以衡量化学键的强弱,也可以用于估算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差.参考以下表格的键能数据,回答下列问题:| 化学键 | Si-O | Si-Cl | H-H | H-Cl | Si-Si | Si-C |
| 键能/kJ•mol-1 | 460 | 360 | 436 | 431 | 176 | 347 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 与硝酸银溶液反应生成AgBr | B. | 使溴的四氯化碳溶液褪色 | ||
| C. | 与金属钠反应放出氢气 | D. | 使高锰酸钾溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
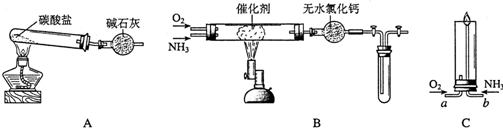
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2和O3 | B. | H2O2和HCl | C. | NH2-和H2O | D. | CH4和NH4+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com