
����Ŀ��ij������X��һ����Ҫ���л�����ԭ�ϣ�����ʽC7H8 �� ������Ϊ��ʼԭ����Ƴ���ͼת����ϵͼ�����ֲ���ϳ�·�ߡ���Ӧ������ȥ��������A��һ�ȴ��F�ķ���ʽΪC7H7NO2 �� Y��һ�ֹ��ܸ߷��Ӳ��ϣ�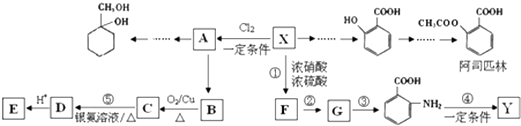
��֪������Ϣ��
��������ڸ�����ص������£��������������Ȼ� ![]()
�� ![]() ���������ױ�������
���������ױ�������
����ݱ���������Ϣ����ѧ֪ʶ�ش��������⣺
��1��X�Ľṹ��ʽ�� �� ��˴Ź�������ͼ�������շ壻
��2���л���C�Ľṹ��ʽ����
��3����˾ƥ�ַ����к��еĹ����ŵ���������1mol��˾ƥ��������NaOH��Һ��Ӧ�������NaOH�����ʵ���Ϊmol��
��4��Y�Ľṹ��ʽΪ��
��5��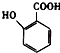 �ж���ͬ���칹�壬���к���1��ȩ����2���ǻ��ķ����廯���ﹲ���֣�
�ж���ͬ���칹�壬���к���1��ȩ����2���ǻ��ķ����廯���ﹲ���֣�
��6����������A���������ʺϳ� 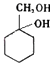 �����̣�A
�����̣�A ![]() �ס���
�ס��� ![]()
![]()
![]()
![]() �ס��ҷ�Ӧ�Ļ�ѧ����ʽΪ ��
�ס��ҷ�Ӧ�Ļ�ѧ����ʽΪ ��
���𰸡�
��1��![]() ��4
��4
��2��![]()
��3���������Ȼ���3
��4��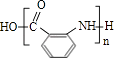
��5��6
��6��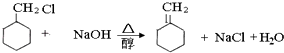
���������⣺ij������X��һ����Ҫ���л�����ԭ�ϣ�����ʽC7H8 �� ��AΪ�ױ�����ṹ��ʽΪ ![]() ��X����������ȡ����Ӧ����A��Aת������B��B����������C��C����������Һ��Ӧ����D����B���д��ǻ���C����ȩ������AΪ
��X����������ȡ����Ӧ����A��Aת������B��B����������C��C����������Һ��Ӧ����D����B���д��ǻ���C����ȩ������AΪ ![]() ��BΪ
��BΪ ![]() ��CΪ
��CΪ ![]() ��D�ữ����E����DΪ
��D�ữ����E����DΪ ![]() ��EΪ
��EΪ ![]() ��
�� ![]() ��Ũ���ᡢ������������Ũ���ᷢ��ȡ����Ӧ����F�����F�ķ���ʽ���۵IJ����֪FΪ
��Ũ���ᡢ������������Ũ���ᷢ��ȡ����Ӧ����F�����F�ķ���ʽ���۵IJ����֪FΪ ![]() ��Fת������G�����ڱ������ױ��������ɷ�Ӧ��Ϣ��Ӧ��Ϣ���֪��GΪ
��Fת������G�����ڱ������ױ��������ɷ�Ӧ��Ϣ��Ӧ��Ϣ���֪��GΪ ![]() ��Y��һ�ֹ��ܸ߷��ӣ��������ΪC7H5NO����
��Y��һ�ֹ��ܸ߷��ӣ��������ΪC7H5NO���� ![]() �ķ���ʽ��ȼ���1����H2O��
�ķ���ʽ��ȼ���1����H2O�� ![]() ͨ���γ��ļ��������۷�Ӧ�ĸ߾��YΪ
ͨ���γ��ļ��������۷�Ӧ�ĸ߾��YΪ 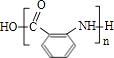 ����1��ͨ�����Ϸ���֪��X�Ǽױ�����ṹ��ʽΪ
����1��ͨ�����Ϸ���֪��X�Ǽױ�����ṹ��ʽΪ ![]() ���������к���4����ԭ�ӣ����Ժ˴Ź���������4�����շ壬���Դ��ǣ�
���������к���4����ԭ�ӣ����Ժ˴Ź���������4�����շ壬���Դ��ǣ� ![]() ��4����2��ͨ�����Ϸ���֪��CΪ����ȩ����ṹ��ʽΪ
��4����2��ͨ�����Ϸ���֪��CΪ����ȩ����ṹ��ʽΪ ![]() �����Դ��ǣ�
�����Դ��ǣ� ![]() ����3����˾ƥ�ֵĹ��������������Ȼ�������ˮ�����ɵķ��ǻ����Ȼ���ԭ���Ȼ������������Ʒ�Ӧ������1mol��˾ƥ��������NaOH��Һ��Ӧ�������NaOH�����ʵ���Ϊ3mol�����Դ��ǣ��������Ȼ���3����4��ͨ�����Ϸ���֪��Y�ṹ��ʽΪ
����3����˾ƥ�ֵĹ��������������Ȼ�������ˮ�����ɵķ��ǻ����Ȼ���ԭ���Ȼ������������Ʒ�Ӧ������1mol��˾ƥ��������NaOH��Һ��Ӧ�������NaOH�����ʵ���Ϊ3mol�����Դ��ǣ��������Ȼ���3����4��ͨ�����Ϸ���֪��Y�ṹ��ʽΪ 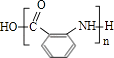 �����Դ��ǣ�
�����Դ��ǣ� 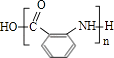 ����5��
����5�� 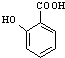 �ж���ͬ���칹�壬���к���1��ȩ����2���ǻ�������2���ǻ����ڣ���ȩ����2��λ�ã������ǻ���ȩ�����ڣ�����һ���ǻ���4��λ�ã�����6��ͬ���칹�壬���Դ��ǣ�6����6��A��
�ж���ͬ���칹�壬���к���1��ȩ����2���ǻ�������2���ǻ����ڣ���ȩ����2��λ�ã������ǻ���ȩ�����ڣ�����һ���ǻ���4��λ�ã�����6��ͬ���칹�壬���Դ��ǣ�6����6��A�� ![]() ��A�����������ӳɷ�Ӧ���ɼף���Ϊ
��A�����������ӳɷ�Ӧ���ɼף���Ϊ ![]() ����Ӧ����B��B���巢���ӳɷ�Ӧ����
����Ӧ����B��B���巢���ӳɷ�Ӧ���� ![]() ���������ȥ��Ӧ����B��BΪ
���������ȥ��Ӧ����B��BΪ ![]() ��
�� ![]() ����ȡ����Ӧ����
����ȡ����Ӧ���� ![]() ����������ҵķ�Ӧ����ʽΪ
����������ҵķ�Ӧ����ʽΪ 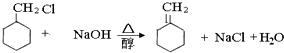 �����Դ��ǣ�
�����Դ��ǣ�  ��
��


 ��Уͨ��֤��Ч��ҵϵ�д�
��Уͨ��֤��Ч��ҵϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ�˱���NO��NO2��N2O4�Դ�������Ⱦ��������NaOH��Һ�������մ���(��Ӧ����ʽ��2NO2��2NaOH===NaNO3��NaNO2��H2O��NO2��NO��2NaOH===2NaNO2��H2O)��������a mol NO��b mol NO2��c mol N2O4��ɵĻ������ǡ�ñ�V L NaOH��Һ����(������ʣ��)�����NaOH��Һ�����ʵ���Ũ��Ϊ(����)
A. ![]() mol��L��1 B.
mol��L��1 B. ![]() mol��L��1
mol��L��1
C. ![]() mol��L��1 D.
mol��L��1 D. ![]() mol��L��1
mol��L��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ��mA��g��+nB��g��pC��g�����ﵽƽ��������¶�ʱ��B��ת���ʱ����Сѹǿʱ�������ϵ��C����������Ҳ��С����
��1��m+np���������=������������
��2������ѹʱ��A���������� �� ���������С�����䡱����ͬ��
��3��������A��������䣩����B��ת���� ��
��4���������¶ȣ���ƽ��ʱB��C��Ũ��֮�� ![]() �� ��
�� ��
��5�������������ƽ��ʱ��������������ʵ��� ��
��6����B����ɫ���ʣ�A��C����ɫ��ά��������ѹǿ���䣬��������ʱ���������ɫ����������dz�����䡱����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���йذ���ʵ������ȡ������ʵ�����£�
��1��ʵ������ȡ�����Ļ�ѧ����ʽΪ____________________________����֤�����Ƿ��ռ����ķ�����________________________��
��2����ͼ��ʵ���ҽ��а�������ˮ����Ȫʵ��װ�ã����������������________��


A����ʵ��˵��������һ�ּ�������ˮ������
B��������ƿ�е�Һ����ɫ����ɫ��Ϊ��ɫ��˵����ˮ�ʼ���
C���γ���Ȫ��ԭ���ǰ�������ˮ����ƿ�ڵ���ѹС�ڴ���ѹ
D�����������氱�������ô�װ��Ҳ�ɽ�����Ȫʵ��
��3������İ����ڸ������ܱ�����ͭ�������������ֵ��ʺ�һ�ֻ������Ӧ�Ļ�ѧ����ʽ��___________________________________��
��4��д��Cu��Ũ�����ڼ��������·�Ӧ�Ļ�ѧ����ʽ_____________________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ�����ӷ���ʽ��д��ȷ����(����)
A. ���Ȼ�����Һ�м��������ˮ��Al3����4NH3��H2O===AlO2����4NH4+��2H2O
B. ��ŨNaOH��Һ�ܽ�Al2O3��2OH����Al2O3===2AlO![]() ��H2O
��H2O
C. ��Ũ�ռ���Һ�м�����ƬAl��2OH��=== AlO2����H2��
D. ��̼��þ�еμ�ϡ���CO32����2H��===CO2����H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��HCN��aq����NaOH��aq����Ӧ�ġ�H=��12.1kJmol��1��HCl��aq����NaOH��aq���кͷ�Ӧ�ġ�H=��55.6kJmol��1 �� ��HCN��ˮ��Һ�е���ġ�H���ڣ� ��
A.+43.5kJmol��1
B.��43.5kJmol��1
C.��67.7kJmol��1
D.+67.7kJmol��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����11.2g���ۺ�3.2g��۾��Ȼ�ϣ����ܱ������м��ȵ����ȣ���ȴ��������������ᣬ�ڱ�״�����ռ������������Ϊ ( )
A��11.2L B��5.6L C��4.48L D��2.24L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��B��C��D��E������ֱ���NaOH��NH3H2O��CH3COOH��HCl��NH4HSO4�е�һ�֣������½�������ʵ�飺
��0.001mol/L��A��ҺpH=3��
��B��Һ��D��Һ�Լ��ԣ���Ũ������PH��ϵB��D��
��E��������ʣ��ش��������⣺
��1��D����Һ���ж������� ��
��2����ˮϡ��0.1molL��1 Bʱ����Һ������ˮ�������Ӷ���С��������д��ţ���
�� ![]() ��
�� ![]() ��c��H+����c��OH�����ij˻� ��OH�������ʵ���
��c��H+����c��OH�����ij˻� ��OH�������ʵ���
��3����������������ʵ���Ũ��B��C����Һ��ϣ������¶ȣ����ʲ���ֽ⣩��ҺpH���¶ȱ仯Ϊͼ�е����ߣ���д��ţ���
��4��OH��Ũ����ͬ�ĵ������������ҺA��E���ֱ���п�۷�Ӧ����������һ����Һ�д���п���ų�������������ͬ��������˵����ȷ��������д��ţ���
�ٷ�Ӧ����Ҫ��ʱ��E��A
�ڿ�ʼ��Ӧʱ������A��E
�۲μӷ�Ӧ��п�����ʵ���A=E
�ܷ�Ӧ���̵�ƽ������E��A
��A��Һ����пʣ��
��E��Һ����пʣ�࣮
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������FeCl3��AlCl3�Ļ����Һ100mL����μ���NaOH��Һ�����ɳ��������ʵ���������NaOH�����ʵ����Ĺ�ϵ��ͼ��������FeCl3��AlCl3�����ʵ���Ũ�ȸ�Ϊ���٣� 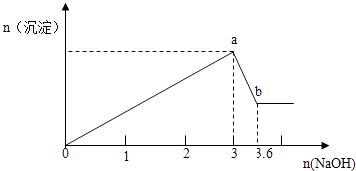
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com