
| A. | 2NO2(g)?N2O4(g) | B. | 2HI(g)?H2(g)+I2(g) | ||
| C. | PCl5?PCl3(g)+Cl2(g) | D. | CaCO3(s)?CaO(g)+CO2 (g) |
分析 若保持各自的温度、体积不变,再加入一定量的反应物,可以等效为将原来的容器缩小体积,实际上增大的反应体系的压强,根据压强对化学平衡的影响进行分析解答.
解答 解:若保持各自的温度、体积不变,再加入一定量的反应物,可以等效为将原来的容器缩小体积,实际上增大的反应体系的压强,
A、该反应正反应是气体体积减小的可逆反应,增大压强,平衡向正反应方向移动,所以转化率增大,故A正确;
B、该反应是一个反应前后气体体积不变的可逆反应,增大压强,平衡不移动,所以转化率不变,故B错误;
C、该反应正反应是气体体积增大的可逆反应,增大压强,平衡向逆反应方向移动,所以转化率减小,故C错误;
D、该反应物为固态,所以增加一定量的反应物,平衡不移动,所以转化率不变,故D错误;
故选A.
点评 本题考查了外界条件对化学平衡的影响,利用等效平衡把改变物质的浓度转化为压强,根据压强对化学平衡的影响来分析解答较简便,难度中等.


科目:高中化学 来源: 题型:解答题
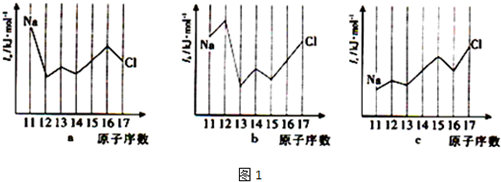
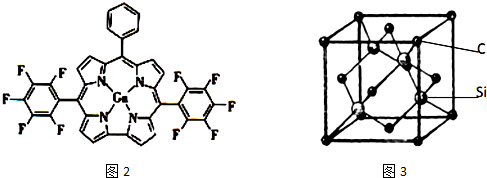
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{48}^{112}$Cd原子的中子数为64 | |
| B. | 聚氯化铝能降污是因为它有强氧化性 | |
| C. | 聚氯化铝是混合物 | |
| D. | 镉的单质有导电性和延展性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 体积大小:③>②>① | B. | 原子数目:③>①>② | C. | 密度大小:②>③>① | D. | 质量大小:②>①>③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 还原剂与氧化产物的物质的量之比为5:8 | |
| B. | 若氧化产物比还原产物多1.4mol则转移电子为1mol | |
| C. | 每生成1.6mol氮气,则有0.2molKNO3被氧化 | |
| D. | NaN3属于硝酸盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
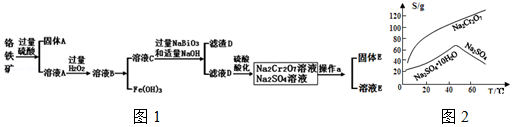
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
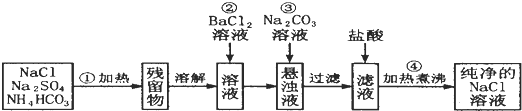
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com