
| 元素 | A | B | C | D |
| 性质、结构信息 | 价电子数为5的短周期元素;该元素形成的双原子分子一般情况下很稳定. | 基态原子的M层有1对成对的p电子. | 第三周期中电离能最小的元素. | 原子最外电子层上s电子数等于p电子数. 其一种单质为自然界中硬度最大的非金属单质. |
 ,故答案为:
,故答案为: ;
;

科目:高中化学 来源: 题型:
| A、①、②、③、⑤、⑥ |
| B、②、③、⑤、⑥ |
| C、②、③、⑤、⑥、⑦ |
| D、②、③、④、⑥、⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:
 下表中各组物质之间不能通过一步反应实现如图的是( )
下表中各组物质之间不能通过一步反应实现如图的是( ) | 甲 | 乙 | 丙 | |
| A | NaHCO3 | Na2CO3 | NaCl |
| B | SiO2 | HSiO3 | Na2SiO3 |
| C | Cl2 | HCl | CuCl2 |
| D | AlCl3 | Al(OH)3 | Al2O3 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NH4HCO3溶于过量的浓KOH溶液中:NH4++HCO3-+2OH-=CO32-+NH3↑+2 H2O |
| B、向明矾溶液中滴加Ba(OH)2溶液,恰好使SO42-沉淀完全:2Al3++3SO42-+3Ba2++6OH -=2 Al(OH)3↓+3BaSO4↓ |
| C、向FeBr2溶液中通入足量氯气:2Fe2++Cl2=2 Fe3++2 Cl- |
| D、醋酸除去水垢:2H++CaCO3=Ca2++CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、“类钫”在化合物中是+1价 |
| B、“类钫”具有放射性 |
| C、“类钫”单质的密度大于l g?cm-3 |
| D、“类钫”单质有较高的熔点 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 液反应生成盐;丙、戊可组成化合物M.
液反应生成盐;丙、戊可组成化合物M.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
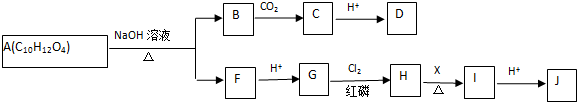
| Cl2 |
| 红磷 |
 +HCl
+HCl查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com