
،¾جâؤ؟،؟ؤ³رذ¾؟ذشر§د°ذ،×é¶شآءبب·´س¦تµرéص¹؟ھرذ¾؟،£دضذذ¸كضذ»¯ر§½ج²ؤضذ¶ش،°آءبب·´س¦،± µؤدضدَسذصâرùµؤأèتِ£؛،°·´س¦·إ³ِ´َء؟µؤبب£¬²¢·¢³ِز«رغµؤ¹âأ¢،±،¢،°ض½آ©¶·µؤدآ²؟±»ةص´©£¬سذ بغبعخïآنبثة³ضذ،±،£–ثشؤ،¶»¯ر§تض²ل،·ضھ£¬Al،¢Al2O3،¢Fe،¢Fe2O3µؤبغ،¢·ذµمت¾فبçدآ£؛
خïضت | Al | Al2O3 | Fe | Fe2O3 |
بغµم/،و | 660 | 2 054 | 1535 | 1462 |
·ذµم/،و | 2467 | 2980 | 2750 | ،ھ |
I.£¨1£©ؤ³ح¬ر§حئ²â£¬آءبب·´س¦ثùµأµ½µؤبغبعخïس¦تاجْآء؛د½ً،£ہيسةتا£؛¸أ·´س¦·إ³ِµؤببء؟ت¹جْبغ»¯£¬¶ّآءµؤبغµم±بجْµؤµح£¬´ثت±ز؛ج¬µؤجْ؛حآءبغ؛دذخ³ةجْآء؛د½ً،£ؤمبدخھثûµؤ½âتحتا·ٌ؛دہي£؛________(جî،°؛دہي،±»ٍ،°²»؛دہي،±£©،£
£¨2£©ةèضز»¸ِ¼ٍµ¥µؤتµرé·½°¸£¬ض¤أ÷ةدتِثùµأµؤ؟é×´بغبعخïضذ؛¬سذ½ًتôآء،£¸أتµرéثùسأتش¼ءتا________£¬·´س¦µؤہë×س·½³جت½خھ___________،£
II.تµرéرذ¾؟·¢دض£¬دُثل·¢ةْرُ»¯»¹ش·´س¦ت±£¬دُثلµؤإ¨¶بش½د،£¬¶شس¦»¹ش²ْخïضذµھشھثطµؤ»¯؛د¼غش½µح،£ؤ³ح¬ر§ب،ز»¶¨ء؟ةدتِµؤبغبعخïسëز»¶¨ء؟؛ـد،µؤدُثل³ن·ض·´س¦£¬·´س¦¹³جضذخقئّجه·إ³ِ،£بôجْ±»رُ»¯خھFe3+£¬شع·´س¦½لتّ؛َµؤبـز؛ضذ£¬ضًµخ¼سبë4mol/Lµؤاâرُ»¯ؤئبـز؛£¬ثù¼ساâرُ»¯ؤئبـز؛µؤجه»£¨mL)سë²ْةْµؤ³ءµيµؤخïضتµؤء؟£¨mol£©µؤ¹طدµبçح¼ثùت¾،£

»ط´ًدآءذختجâ£؛
£¨1£©ح¼ضذOC¶خأ»سذ³ءµيةْ³ة£¬´ث½×¶خ·¢ةْ·´س¦µؤہë×س·½³جت½خھ____________،£شعDE¶خ£¬³ءµيµؤخïضتµؤء؟أ»سذ±ن»¯£¬شٍ´ث½×¶خ·¢ةْ·´س¦µؤہë×س·½³جت½خھ____________،£
£¨2£©BسëAµؤ²îضµخھ_________mol،£Bµم¶شس¦µؤ³ءµيµؤخïضتµؤء؟خھ___________mol£¬Cµم¶شس¦µؤاâرُ»¯ؤئبـز؛µؤجه»خھ____________mL،£
،¾´ً°¸،؟I£¨1£©؛دہي £¨2£©NaOHبـز؛ 2Al+2OH-+2H2O=2AlO2-+3H2،ü£»
II£¨1£© H++OH-=H2O NH4++OH-=NH3،¤H2O£»£¨2£©0.008 0.032mol 7mL
،¾½âخِ،؟تشجâ·ضخِ£؛I£®£¨1£©¸أ·´س¦·إ³ِµؤببء؟ت¹جْبغ»¯£¬¶ّآءµؤبغµم±بجْµح£¬´ثت±·´س¦²ْةْµؤز؛ج¬µؤجْ؛ح¹ء؟µؤآءبغ؛دذخ³ةجْآء؛د½ً،£ثùزشثûµؤ½âتحتا؛دہيµؤ£»
£¨2£©ہûسأAlؤـ¹»سëا؟¼îبـز؛·¢ةْ·´س¦²ْةْاâئّ£¬¶ّFeسëAl²»ؤـ·¢ةْ·´س¦µؤذشضت¼سزشرéض¤£¬ثùزش¸أتµرéثùسأتش¼ءتاNaOHبـز؛£¬·´س¦µؤ»¯ر§·½³جت½تا£؛2Al+2OH-+2H2O=2AlO2-+3H2،ü£»
II£®£¨1£©دٍسأدُثلبـ½â¸أ½ًتôµؤبـز؛ضذ¼سبëNaOHبـز؛£¬خق³ءµي²ْةْ£¬تاسةسعثل¹ء؟£¬¼سبëµؤNaOHت×دبسë¹ء؟µؤثل·¢ةْضذ؛ح·´س¦£¬ثùزشOC¶خہë×س·½³جت½تا£؛H++OH-=H2O£»
£¨2£©شعCD¶خبـز؛ضذµؤFe3+،¢Al3+·¢ةْ³ءµي·´س¦ذخ³ةFe(OH)3،¢Al(OH)3³ءµي£»شعDE¶خ£¬³ءµيµؤخïضتµؤء؟أ»سذ±ن»¯£¬تازٍخھشعDE¶خNaOHبـز؛سëدُثل±»»¹شخھNH4NO3,¶صك·¢ةْ¸´·ض½â·´س¦£¬ہë×س·½³جت½تا£؛NH4++ OH-=NH3،¤H2O£»
£¨3£©شعEF¶خNaOHبـ½âAl(OH)3³ءµي£¬ہë×س·½³جت½تا£؛Al(OH)3+ OH-=AlO2-+ 2H2O،£بـ½âAl(OH)3دû؛ؤµؤNaOHµؤخïضتµؤء؟تاn(NaOH)=4mol/L،ء0.002L=0.008mol£¬ثùزش¸ù¾ف·´س¦·½³جت½ضذ¶صكµؤخïضتµؤء؟¹طدµ؟ةضھ£؛n(Al(OH)3)=0.008mol£¬²ْةْAl(OH)3³ءµيدû؛ؤµؤNaOHبـز؛µؤجه»تا6mL£»¸ù¾ف·´س¦·½³جت½NH4++ OH-=NH3،¤H2O ؟ةضھ£؛n(NH4+) = 4mol/L ،ء 0.003L = 0.012mol£¬n(e-) =" 0.012mol" ،ء 8 = 0.096mol،£Fe،¢Al¶¼تا+3¼غµؤ½ًتô£¬سةسعشع·´س¦¹³جضذµç×س×ھزئتؤ؟دàµب£¬ثùزشn(Fe)+n(Al) =" 0.096mol،آ3" = 0.032mol£¬ثùزششعBµم¶شس¦µؤ³ءµيµؤخïضتµؤء؟سë½ًتôµؤخïضتµؤء؟دàµب£¬خھ0.032mol£»ت¹Al3+،¢Fe3+ذخ³ة³ءµيدû؛ؤµؤNaOHµؤخïضتµؤء؟سëµç×سµؤخïضتµؤء؟دàµب£¬تا0.096mol£¬شٍئندû؛ؤNaOHبـز؛µؤجه»تاV£¨NaOH£© =" 0.096mol" ،آ4mol/L =" 0.024L" = 24mL£¬ثùزش Cµم¶شس¦µؤاâرُ»¯ؤئبـز؛µؤجه»خھ31mL-24mL = 7mL،£


 µ¼ر§ب«³جء·´´سإرµء·دµءذ´ً°¸
µ¼ر§ب«³جء·´´سإرµء·دµءذ´ً°¸
| ؤ꼶 | ¸كضذ؟خ³ج | ؤ꼶 | ³ُضذ؟خ³ج |
| ¸كز» | ¸كز»أâ·ر؟خ³جحئ¼ِ£، | ³ُز» | ³ُز»أâ·ر؟خ³جحئ¼ِ£، |
| ¸ك¶ | ¸ك¶أâ·ر؟خ³جحئ¼ِ£، | ³ُ¶ | ³ُ¶أâ·ر؟خ³جحئ¼ِ£، |
| ¸كب | ¸كبأâ·ر؟خ³جحئ¼ِ£، | ³ُب | ³ُبأâ·ر؟خ³جحئ¼ِ£، |
؟ئؤ؟£؛¸كضذ»¯ر§ ہ´ش´£؛ جâذح£؛
،¾جâؤ؟،؟دآءذ½ًتôµ¥ضت£¬»îئأذش×îا؟µؤتا( )
A. Na B. K C. Cu D. Zn
²é؟´´ً°¸؛ح½âخِ>>
؟ئؤ؟£؛¸كضذ»¯ر§ ہ´ش´£؛ جâذح£؛
،¾جâؤ؟،؟ؤ³ذثب¤ذ،×éسأدآح¼ثùت¾×°ضأضئ±¸ئّجه(¾ئ¾«µئ؟ةزش¸ù¾فذèزھر،شٌ£©£¬¶شس¦ثµ·¨صب·µؤتا

ر،دî | ¢ظضذز©ئ· | ¢عضذز©ئ· | ¢غضذز©ئ· | ¢ـضذز©ئ· | ضئ±¸ئّجه | ¢قضذز©ئ·¼°×÷سأ |
A | إ¨رخثل | MnO2 | ±¥؛حت³رخث® | إ¨ءٍثل | C12 | NaOHبـز؛£¬خ²ئّخüتص |
B | د،دُثل | Cu | ةص¼îبـز؛ | إ¨ءٍثل | NO | Na()Hبـز؛£¬خ²ئّخüتص |
C | إ¨رخثل | ´َہيت¯ | ±¥؛حNa2CO3بـز؛ | إ¨ءٍثل | CO2 | ³خاهت¯»زث®£¬¼ىرéCO2 |
D | إ¨رخثل | Zn | ث® | إ¨ءٍثل | H2 | ؟ة³·ب¥ |
A. A B. B C. C D. D
²é؟´´ً°¸؛ح½âخِ>>
؟ئؤ؟£؛¸كضذ»¯ر§ ہ´ش´£؛ جâذح£؛
،¾جâؤ؟،؟دآءذخïضتضذؤـت¹ثلذش¸كأجثل¼طبـز؛حتة«µؤتا£¨ £©
A. ¾غززد© B. ززحé C. زز´¼ D. ززثل
²é؟´´ً°¸؛ح½âخِ>>
؟ئؤ؟£؛¸كضذ»¯ر§ ہ´ش´£؛ جâذح£؛
،¾جâؤ؟،؟
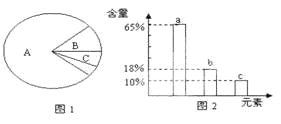
A. بôح¼1±يت¾ص³£د¸°û£¬شٍA،¢B»¯؛دخï¹²سذµؤشھثطضذ؛¬ء؟×î¶àµؤتاa
B. بôح¼1±يت¾د¸°ûحêب«حرث®؛َ»¯؛دخï؛¬ء؟ةبذخح¼£¬شٍAضذ؛¬ء؟×î¶àµؤشھثطخھح¼2µؤb
C. ةدح¼2ضذتء؟×î¶àµؤشھثطتاج¼شھثط£¬صâسëد¸°ûضذ؛¬ء؟×î¶àµؤ»¯؛دخïسذ¹ط
D. بôح¼1±يت¾ص³£د¸°û£¬شٍB»¯؛دخï¾كسذ¶àرùذش£¬ئن±ط؛¬µؤشھثطخھC،¢H،¢0،¢N
²é؟´´ً°¸؛ح½âخِ>>
؟ئؤ؟£؛¸كضذ»¯ر§ ہ´ش´£؛ جâذح£؛
،¾جâؤ؟،؟»¯ر§سëةْ»î،¢ةْ²ْأـاذدà¹ط،£دآءذثµ·¨صب·µؤتا
A. KA1(SO4)2،¤12H2O³£سأسعة±¾ْدû¶¾
B. ةْ»îضذ؟ةسأخقث®زز´¼دû¶¾
C. دثخ¬ثطشعبثجهؤعث®½âµأµ½ئدجرجا
D. إفؤأً»ًئ÷ضذµؤ·´س¦خïتاNaHCO3؛حAl2(SO4)3
²é؟´´ً°¸؛ح½âخِ>>
؟ئؤ؟£؛¸كضذ»¯ر§ ہ´ش´£؛ جâذح£؛
،¾جâؤ؟،؟دآءذثµ·¨´يخَµؤتا
A. ب¼ءدµؤب¼ةص·´س¦¶¼تا·إبب·´س¦
B. ز»¶¨ء؟µؤب¼ءدحêب«ب¼ةص·إ³ِµؤببء؟±ب²»حêب«ب¼ةص·إ³ِµؤببء؟´َ
C. ·إبب·´س¦µؤؤو·´س¦ز»¶¨تاخüبب·´س¦
D. ¼سببؤـ·¢ةْµؤ·´س¦تاخüبب·´س¦
²é؟´´ً°¸؛ح½âخِ>>
؟ئؤ؟£؛¸كضذ»¯ر§ ہ´ش´£؛ جâذح£؛
،¾جâؤ؟،؟دآءذخïضتضذ×îؤرµçہë³ِ H+µؤتا£¨ £©
A. CH3CH2OH B. CH3COOH C. H2O D. HCl
²é؟´´ً°¸؛ح½âخِ>>
؟ئؤ؟£؛¸كضذ»¯ر§ ہ´ش´£؛ جâذح£؛
،¾جâؤ؟،؟سأNA±يت¾°¢·ü¼سµآآق³£تµؤضµ£¬دآءذذًتِضذصب·µؤتا
A. 100Cت±£¬1L pH=6´؟ث®ضذ؛¬H+تؤ؟خھ10-6NA
B. 0.1mol،¤L-1 Na2CO3بـز؛ضذ£¬Na+µؤتؤ؟خھ0.2NA
C. ³£خآ³£ر¹دآ£¬17gôا»ù£¨،ھ18OH£©ثù؛¬ضذ×ستخھ9NA
D. ±ê×¼×´؟ِدآ£¬22.4L CHCl3ضذثù؛¬C،ھCl¼üµؤتؤ؟خھ3NA
²é؟´´ً°¸؛ح½âخِ>>
°ظ¶بضآذإ - ء·د°²لءذ±ي - تشجâءذ±ي
؛±±ت،»¥ءھحّخ¥·¨؛ح²»ء¼ذإد¢¾ظ±¨ئ½ج¨ | حّةدسذ؛¦ذإد¢¾ظ±¨×¨اّ | µçذإص©ئ¾ظ±¨×¨اّ | ةوہْت·ذéخقض÷زهسذ؛¦ذإد¢¾ظ±¨×¨اّ | ةوئَاضب¨¾ظ±¨×¨اّ
خ¥·¨؛ح²»ء¼ذإد¢¾ظ±¨µç»°£؛027-86699610 ¾ظ±¨ستدن£؛58377363@163.com