
| A. | Fe2+ | B. | Fe3+ | C. | Fe3+、Cu2+ | D. | Fe2+ Cu2+ |
 全优点练单元计划系列答案
全优点练单元计划系列答案科目:高中化学 来源: 题型:解答题
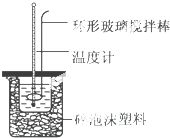 实验室用50mL 0.50mol•L-1盐酸、50mL 0.55mol•L-1 NaOH溶液和如图所示装置,进行测定中和热的实验,得到下表中的数据
实验室用50mL 0.50mol•L-1盐酸、50mL 0.55mol•L-1 NaOH溶液和如图所示装置,进行测定中和热的实验,得到下表中的数据| 实验次数 | 起始温度t1/℃ | 终止温 度t2/℃ | |
| 盐酸 | NaOH溶液 | ||
| 1 | 20.2 | 20.3 | 23.7 |
| 2 | 20.3 | 20.5 | 23.8 |
| 3 | 21.5 | 21.6 | 24.9 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 容器编号 | c(H2O)/mol•L-1 | c(CO)/mol•L-1 | c(H2)/mol•L-1 | ν正、ν逆比较 |
| I | 0.06 | 0.60 | 0.10 | ν正=ν逆 |
| Ⅱ | 0.12 | 0.20 | ①0.6 | ν正=ν逆 |
| Ⅲ | 0.10 | 0.20 | 0.40 | ②ν正>ν逆 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,该化合物是由离子键形成.
,该化合物是由离子键形成.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①、②、⑥分子中碳原子数小于10,③、⑤分子中碳原子数大于10 | |
| B. | ①、②是无机物,③、⑤、⑦是有机物 | |
| C. | ①、④是酸,③、⑤不是酸 | |
| D. | ②、③、④含氧元素,⑤、⑥、⑦不含氧元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 以上反应均可发生 | B. | 只有⑦不能发生 | ||
| C. | 只有⑥不能发生 | D. | 只有②不能发生 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在熔融状态下,1molNa2O2完全电离出的离子数目为3NA(NA代表阿伏加德罗常数的值) | |
| B. | 酸性氧化物不一定是非金属氧化物,碱性氧化则一定是金属氧化物 | |
| C. | 常温下醋酸分子不可能存在于pH>7的碱性溶液中 | |
| D. | 第ⅥA族元素的氢化物中,稳定性最好的其沸点也最高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | O2、O3 | B. | H2、D2、T2 | C. | H2O、D2O、T2O | D. | ${\;}_{1}^{1}$H ${\;}_{1}^{2}$H |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com