
 A、B、C、D、E 分别代表中学化学中的常见物质,请根据题目要求回答下列问题:
A、B、C、D、E 分别代表中学化学中的常见物质,请根据题目要求回答下列问题: .
.分析 (1)红褐色液相分散系是Fe(OH)3胶体,则A的饱和溶液是FeCl3饱和溶液,FeCl3饱和溶液在加热条件下水解生成氢氧化铁胶体,HCl具有挥发性,加热促进HCl挥发,从而促进FeCl3水解,蒸干时得到固体Fe(OH)3,灼烧Fe(OH)3得到Fe2O3;
(2)地壳中含量最高的金属元素是Al,则B为AlCl3,根据若碱不足,只发生Al3++3OH-═Al(OH)3↓来计算,若碱与铝离子的物质的量之比大于3:1,小于4:1,发生Al3++3OH-═Al(OH)3↓、Al(OH)3+OH-═AlO2-+2H2O来计算;
(3)Al-Fe-KOH溶液原电池,其中Al为负极,Fe为正极,负极电极反应式为Al-3e-+4OH-=AlO2-+2H2O;
(4)C、D、E均是短周期中同一周期元素形成的单质或化合物,常温下D为固体单质,C和E均为气态化合物,C+D$\stackrel{高温}{→}$E,只可能为C、N、O三元素组成的化合物,综合分析可知:C为CO2,D为碳,E为CO,以此解答该题.
解答 解:(1)红褐色液相分散系是Fe(OH)3胶体,则A的饱和溶液是氯化铁饱和溶液,FeCl3饱和溶液在加热条件下水解生成氢氧化铁胶体,化学方程式为FeCl3+3H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe(OH)3(胶体)+3HCl,HCl具有挥发性,加热促进HCl挥发,从而促进FeCl3水解,蒸干时得到固体Fe(OH)3,灼烧Fe(OH)3得到Fe2O3,化学方程式为反应方程式为2Fe(OH)3$\frac{\underline{\;\;△\;\;}}{\;}$Fe2O3+3H2O,所以最终得到的固体是Fe2O3,
故答案为:FeCl3+3H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe(OH)3(胶体)+3HCl;2Fe(OH)3$\frac{\underline{\;\;△\;\;}}{\;}$Fe2O3+3H2O;
(2)地壳中含量最高的金属元素是Al,则B为AlCl3,
沉淀的质量是7.8g,其物质的量为$\frac{7.8g}{78g/mol}$=0.1mol,
①若碱不足,由Al3++3OH-═Al(OH)3↓可知,
KOH的物质的量为0.1mol×3=0.3mol,
其物质的量浓度为$\frac{0.3mol}{0.1L}$=3mol/L;
②碱与铝离子的物质的量之比大于3:1,小于4:1,
则由 Al3++3OH-═Al(OH)3↓
0.3mol 0.9mol 0.3mol
Al(OH)3+OH-═AlO2-+2H2O
(0.3-0.1)mol 0.2mol
则消耗的碱的物质的量为0.9mol+0.2mol=1.1mol,
其物质的量浓度为$\frac{1.1mol}{0.1L}$=7mol/L;
故答案为:3mol/L或11mol/L;
(3)Al-Fe-KOH溶液原电池,Al和氢氧化钠溶液能发生反应,Fe和氢氧化钠溶液不反应,因此Al为负极,Fe为正极,负极电极反应式为Al-3e-+4OH-=AlO2-+2H2O,
故答案为:Al-3e-+4OH-=AlO2-+2H2O;
(4)C、D、E均是短周期中同一周期元素形成的单质或化合物,常温下D为固体单质,C和E均为气态化合物,C+D$\stackrel{高温}{→}$E,只可能为C、N、O三元素组成的化合物,综合分析可知:C为CO2,D为碳,E为CO,
①CO2中C和O之间以双键相连接,电子式为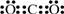 ,
,
故答案为: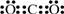 ;
;
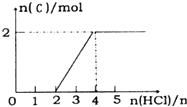
②横坐标2-4之前,发生HCO3-+H+=CO2↑+H2O,消耗HCl为4mol-2mol=2mol,说明HCO3-是2mol,横坐标1-2之间发生反应CO32-+H+=HCO3-,生成2molHCO3-需要消耗2molHCl和2molCO32-,故溶液F为Na2CO3溶液,生成F的离子方程式为CO2+2OH-=CO32-+2H2O;
溶液中CO32-水解,溶液呈碱性,故c (Na+)>c(CO32-)、c(OH-)>c(H+),而HCO3-也水解,且水也电离产生OH-,故c(OH-)>c(HCO3-),碱性条件下c(H+)很小,故离子浓度大小c (Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+),
故答案为:CO2+2OH-=CO32-+2H2O;c (Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+).
点评 本题比较综合,涉及无机物推断、化学计算、原电池、盐类水解等,推断元素化合物是解题的关键,需要学生具备扎实的基础,难度中等.


 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案科目:高中化学 来源: 题型:选择题
| A. | 元素质量数的递增 | B. | 元素的原子半径呈周期性变化 | ||
| C. | 金属性和非金属性呈周期性变化 | D. | 原子核外电子排布呈周期性变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 实验现象 | 实验结论 |
| A | NaHCO3溶液与NaAlO2溶液混合 | 生成白色沉淀 | 结合H+的能力: CO32-<AlO2- |
| B | 常温下,相同的铝片分别投入足量的稀、浓硫酸中 | 浓硫酸中铝片先溶解完 | 反应物浓度越大,反应速率越快 |
| C | 向2mL 2%的CuSO4溶液中加入0.5mL 1%的NaOH溶液,振荡后加入几滴有机试剂X的溶液,加热 | 未出现砖红色沉淀 | 有机试剂X中不含醛基 |
| D | 2mL 0.1mol/L的NaOH溶液中滴加2滴0.1mol/L的MgCl2溶液,再滴加2滴0.1mol/L的FeCl3溶液 | 白色沉淀转化为红褐色沉淀 | 溶解度: Mg(OH)2>Fe(OH)3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
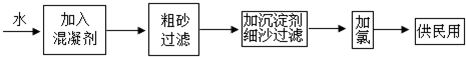
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.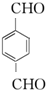 ;
; .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液、胶体、浊液属于不同的分散系 | |
| B. | 胶体与其他分散系的本质区别是胶体分散质粒子直径在1nm-100nm之间 | |
| C. | 可利用丁达尔现象鉴别溶液和胶体 | |
| D. | 利用过滤的方法可以分离胶体和溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molCH5+与1molNH2-所含电子数均为10NA | |
| B. | 60gSiO2晶体中所含[SiO4]四面体数为0.5NA | |
| C. | 25℃,pH=10的Na2CO3溶液中所含OH-数为1×10-4NA | |
| D. | 标准状况下,22.4LCO、NO混合气体中所含氧原子数为2NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com