
【题目】执法交警最常用的一种酒精检测仪的工作原理示意图如图所示,其反应原理为CH3CH2OH+O2=CH3COOH+H2O,被测者呼出气体中所含的酒精被输送到电池中反应产生微小电流,该电流经电子放大器放大后在液晶显示屏上显示其酒精含量。下列说法正确的是( )

A.呼出气体中酒精含量越高,微处理器中通过的电流越小
B.电解质溶液中的H+移向a电极
C.b为正极,电极反应式为O2+2H2O+4e-=4OH-
D.a极上的电极反应式为CH3CH2OH+H2O-4e-=CH3COOH+4H+
科目:高中化学 来源: 题型:
【题目】据研究报道,药物瑞德西韦(Remdesivir)对2019年新型冠状病毒(COVID—19)有明显抑制作用。K为药物合成的中间体,其合成路线如图:
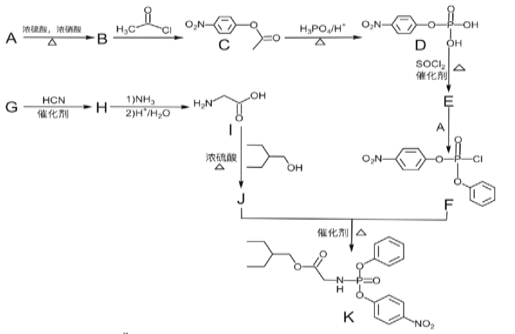
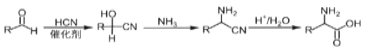
已知:(1)R—OH![]() R—Cl
R—Cl
(2)
回答下列问题:
(1)B的化学名称为__。
(2)J中含氧官能团的名称为__。
(3)B到C的反应类型是___,G到H的反应类型是__。
(4)由G生成H的化学反应方程式为___。
(5)E中含两个Cl原子,则E的结构简式___。
(6)X是C同分异构体,写出满足下列条件的X的结构简式___。
①苯环上含有硝基且苯环上只有一种氢原子;②遇FeCl3溶液发生显色反应;③1mol的X与足量金属Na反应可生成2gH2。
(7)参照F的合成路线图,设计由![]() 、SOCl2为原料制备
、SOCl2为原料制备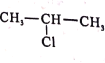 的合成路线(无机试剂任选)___。
的合成路线(无机试剂任选)___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素R、X、T、Z、Q在元素周期表中的相对位置如下表所示,其中R单质在暗处与H2剧烈化合并发生爆炸。则下列判断正确的是
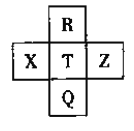
A. 非金属性:Z<T<X
B. R与Q的电子数相差26
C. 气态氢化物稳定性:R<T<Q
D. 最高价氧化物的水化物的酸性:Q>T
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化硼(BN)是一种重要的功能陶瓷材料以天然硼砂为起始物,经过一系列反应可以得到BF3和BN,如图所示:
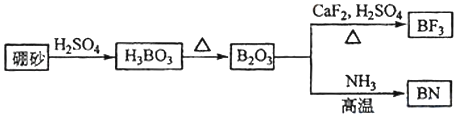
请回答下列问题:
(1)写出B2O3与NH3反应生成BN的化学反应方程式______________
(2)基态N原子的价层电子排布式为________。
(3)B、N、O相比,第一电离能最大的是______,BN中B元素的化合价为_____
(4)写出一个与SO42﹣互为等电子体的微粒__________。
(5)BF3能与NH3反应生成BF3NH3,BF3NH3中BF3与NH3之间通过________(填“离子键”、“配位键”或“氢键”) 结合。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把0.4molX气体和0.6molY气体混合于2L密闭容器中,使它们发生如下反应:4X(g)+5Y(g) ![]() nZ(g)+6W(g)。2min末已生成0.3molW,若测知以Z的浓度变化表示的反应速率为0.05mol/(L·min),试计算
nZ(g)+6W(g)。2min末已生成0.3molW,若测知以Z的浓度变化表示的反应速率为0.05mol/(L·min),试计算
(1)前2min内用W的浓度变化表示的平均反应速率为_______________。
(2)2min末时Y的浓度为_____________________________。
(3)化学反应方程式中n=_____________________________。
(4)2min末,恢复到反应前温度,体系内压强是反应前压强的__________倍。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)乙醇是未来内燃机的首选环保型液体燃料。2.0g乙醇完全燃烧生成液态水放出59.43kJ的热量,则乙醇燃烧的热化学方程式__。
(2)已知下列热化学方程式:
①C(s,石墨)+O2(g)═CO2(g) △H=-393.5kJmol-1
②2H2(g)+O2(g)═2H2O(l) △H=-571.6kJmol-1
③2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l) △H=-2599kJmol-1
请写出C(s,石墨)和H2(g)生成1mol C2H2(g)的热化学方程式_____。
(3)已知几种共价键的键能数据如下表:
共价键 | N≡N | H—H | N—H |
键能(kJ/mol) | 946 | 436 | 390.8 |
写出合成氨反应的热化学方程式:____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】完成下列实验所选择的装置或仪器(夹持装置已略去)正确的是( )
A | B | C | D | |
实验 | 制取少量纯净的CO2气体 | 用CCl4提取溴水中的Br2 | 除去CO2中少量的HCl | 蒸干NaCl饱和溶液制备NaCl晶体 |
装置或仪器 |
|
|
|
|
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铅蓄电池是化学电源,其电极材料分别是Pb和PbO2,电解液为稀硫酸。工作时该电池总反应式为:Pb(s)+PbO2(s)+2H2SO4(aq) ![]() 2PbSO4(s)+2H2O(l)。根据上述情况判断:
2PbSO4(s)+2H2O(l)。根据上述情况判断:
(1)放电时,电解质溶液的pH________(填“增大”“减小”或“不变”)。
(2)放电时,电解质溶液中阴离子移向_____极,电子从_____极流向____极。
(3)写出负极的电极方程式:_____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醛(HCHO)是一种重要的化工产品,工业上可用甲醇脱氢法制备,相关反应方程式为:CH3OH(g) ![]() HCHO(g)+H2(g) △H=+akJ/mol回答下列问题:
HCHO(g)+H2(g) △H=+akJ/mol回答下列问题:
(1)反应过程中需要向体系中通入空气,通过以下反应提供上述反应所需要的热量:H2(g)+![]() O2(g)=H2O(g) △H=-bkJ/mol
O2(g)=H2O(g) △H=-bkJ/mol
要使反应温度维持在650℃,则进料时,甲醇和空气的体积比应为___(已知空气中氧气的体积分数为20%,b>a)。
(2)Na2CO3是甲醇脱氢制甲醛的催化剂,有研究指出,催化反应的部分机理如下:
历程i:CH30H→H+CH2OH(H叫做氢自由基,实际上就是H原子,有很高的反应活性,
“”代表有一个单电子可以参与配对成键)
历程ii:CH2OH→H+HCHO
历程iii:CH2OH→3H+CO
历程iv:自由基发生碰撞形成新化学键而湮灭
如图1所示为在体积为2L的恒容容器中,投入1molCH3OH(g),在碳酸钠催化剂作用下开始反应,20min后,测得甲醇的转化率(X)与甲醛的选择性(S)与温度的关系(副反应仅考虑CH3OH![]() CO+2H2):
CO+2H2):
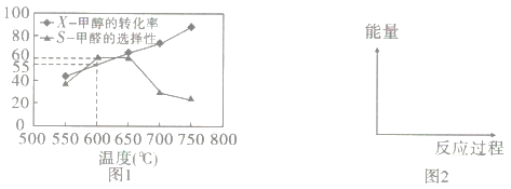
①请在图2所给坐标中,画出历程iv的反应过程一能量变化示意图___。
②下列说法合理的是__。
a.升高温度,甲醇转化率提高,平衡常数变大
b.当体系气体密度保持不变时,达到平衡状态
c.及时分离产品有利于提高甲醇生成甲醛的转化率
③600℃时,前20min甲醇的平均反应速率为__,此时生成甲醛的反应的Qp=___(Qp的表达式与平衡常数Kp相同,p为物质的分压,分压=总压×物质的量分数,体系初始压强为P0)
④650℃以后,甲醛的选择性降低,而甲醇的转化率升高的可能原因是___。
(3)氧化剂可处理甲醛污染,结合以下图像分析夏季(水温约20℃)应急处理甲醛污染的水源最好应选择的试剂为____。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com