
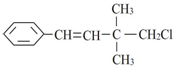 ,关于该有机物,下列叙述不正确的是( )
,关于该有机物,下列叙述不正确的是( )| A. | 所有碳原子不可能在同一平面上 | |
| B. | 属于卤代烃 | |
| C. | 分子式为C12H15Cl | |
| D. | 能发生加成反应、取代反应、加聚反应、消去反应 |
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯 | B. | 乙基(-CH2CH3) | C. | 碳正离子[(CH3)3C+] | D. | 碳烯(:CH2) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 A、B、C、D、E、F、G是核电荷数依次增大的短周期主族元素,A元素原子的核外电子数、电子层数和最外层电子数均相等,元素B的一种常见单质可做惰性电极材料,C、D、G三种元素在周期表中的相对位置如图①所示,C、D、F的质子数之和等于E、G的质子数之和.E、F为金属元素,只有G元素的单质能与水反应生成两种酸.甲、乙、M、W、X、Y、Z七种物质均由A、C、D三种元素中的一种或几种组成,其中只有M分子同时含有三种元素;W为A、C两元素组成的18电子分子,可作火箭燃料;甲、乙为非金属单质.它们之间的转化关系如图②所示.
A、B、C、D、E、F、G是核电荷数依次增大的短周期主族元素,A元素原子的核外电子数、电子层数和最外层电子数均相等,元素B的一种常见单质可做惰性电极材料,C、D、G三种元素在周期表中的相对位置如图①所示,C、D、F的质子数之和等于E、G的质子数之和.E、F为金属元素,只有G元素的单质能与水反应生成两种酸.甲、乙、M、W、X、Y、Z七种物质均由A、C、D三种元素中的一种或几种组成,其中只有M分子同时含有三种元素;W为A、C两元素组成的18电子分子,可作火箭燃料;甲、乙为非金属单质.它们之间的转化关系如图②所示.| C | D | |
| G |
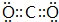 .
.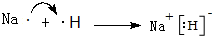 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
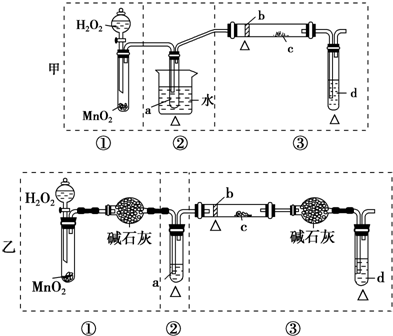
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题



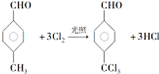 ,反应类型为取代反应
,反应类型为取代反应 +n
+n $\stackrel{催化剂}{→}$
$\stackrel{催化剂}{→}$ +(2n-1)H2O
+(2n-1)H2O 的路线流程图:
的路线流程图: 合成路线流程图示例如下:CH3CH2Br$→_{△}^{NaOH溶液}$CH3CH2OH$→_{浓硫酸,△}^{CH_{3}CH_{2}OH}$CH3COOCH2CH3.
合成路线流程图示例如下:CH3CH2Br$→_{△}^{NaOH溶液}$CH3CH2OH$→_{浓硫酸,△}^{CH_{3}CH_{2}OH}$CH3COOCH2CH3.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
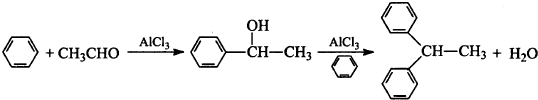
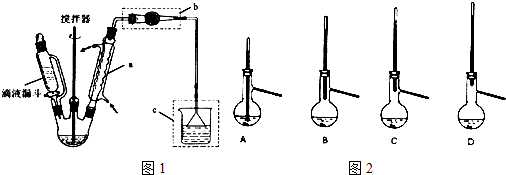
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com