
| A. | 用分液漏斗分离溴乙烷和水的混合物 | |
| B. | 用结晶的方法分离氯化钠和硝酸钾的混合物 | |
| C. | 除去含有少量硝酸钡杂质的硝酸钾,可以加入过量的碳酸钾溶液,过滤后除去沉淀,在滤液中加入适量硝酸调至溶液的pH为7 | |
| D. | 除去乙酸乙酯中的少量乙酸,可以加入乙醇和浓硫酸加热,使乙酸全部转化为乙酸乙酯 |
分析 A.溴乙烷和水互不相溶;
B.氯化钠和硝酸钾的溶解度随温度的变化不同;
C.硝酸钡和碳酸钾反应生成碳酸钡沉淀,过滤后,过量的碳酸钾与硝酸反应可生成硝酸钾;
D.乙醇与乙酸的反应为可逆反应.
解答 解:A.溴乙烷和水互不相溶,可用分液的方法分离,故A正确;
B.氯化钠和硝酸钾的溶解度随温度的变化不同,可用结晶的方法分离,故B正确;
C.硝酸钡和碳酸钾反应生成碳酸钡沉淀,过滤后,过量的碳酸钾与硝酸反应可生成硝酸钾,调至溶液的pH为7,可完成生成硝酸钾,故C正确;
D.乙醇与乙酸的反应为可逆反应,因乙酸乙酯不溶于饱和碳酸钠溶液,乙酸与碳酸钠反应,可用饱和碳酸钠溶液除杂,故D错误.
故选D.
点评 本题考查物质的分离、提纯,为高频考点,侧重于学生的分析、实验能力的考查,注意把握物质的性质的异同以及实验的严密性、可行性的评价,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4 L 14CO2与44 g 14CO2含分子数均为NA | |
| B. | 1 mol CH3COOH与足量CH3CH2OH在浓硫酸存在下共热生成NA个乙酸乙酯分子 | |
| C. | 常温下,pH=13的NaOH溶液中含OH-离子数为0.1 NA | |
| D. | 浓度为2 mol/L的FeCl3溶液500 mL水解后生成Fe(OH)3胶体粒子数目小于NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  负极反应式为2H++2e-═H2↑ | B. |  阳极反应式为Ag++e-═Ag | ||
| C. |  H+向碳棒方向移动 | D. |  电解开始时阳极产生黄绿色气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③④⑤⑥ | B. | ①②③⑤⑥ | C. | ②③⑤⑥ | D. | ①②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;B的结构简式是
;B的结构简式是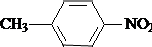 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4 L氯水含有NA个Cl2分子 | |
| B. | 在1 L 0.1 mol•L-1碳酸钠溶液中阴离子总数大于0.1NA | |
| C. | 50 mL18.4 mol•L-1浓硫酸与足量铜微热反应,生成SO2分子数目为0.46NA | |
| D. | 标准状况下,由H2O2制得4.48 LO2转移的电子数目为0.8NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 M和N单质燃烧时均放出大量热,可用作燃料.已知M和N均为短周期元素,其原子的第一至第四电离能如下表所示:
M和N单质燃烧时均放出大量热,可用作燃料.已知M和N均为短周期元素,其原子的第一至第四电离能如下表所示:| 电离能(kJ/mol) | I1 | I2 | I3 | I4 |
| M | 932 | 1821 | 15390 | 21771 |
| N | 738 | 1451 | 7733 | 10540 |
 ,MCl2是非极性(填“极性分子”或“非极性分子”);N的核外电子排布如图所示,该同学所画的电子排布图违背了能量最低原理.
,MCl2是非极性(填“极性分子”或“非极性分子”);N的核外电子排布如图所示,该同学所画的电子排布图违背了能量最低原理.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com