|
工业上用CO来生产燃料甲醇.一定条件下发生反应:CO(g)+2H2(g)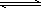 CH3OH(g).图1表示反应过程中能量的变化情况;图2表示一定温度下,向固定体积为2 L的容器中加入4 mol H2和一定量的CO后,CO(g)和CH3OH(g)的物质的量 CH3OH(g).图1表示反应过程中能量的变化情况;图2表示一定温度下,向固定体积为2 L的容器中加入4 mol H2和一定量的CO后,CO(g)和CH3OH(g)的物质的量
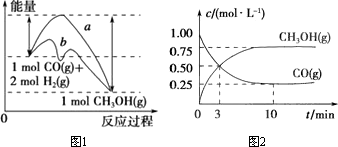
请回答下列问题:
(1)在图1中,曲线________(填“a”或“b”)表示反应使用了催化剂;该反应属于________(填“吸热”或“放热”)反应.
(2)根据图2判断下列说法中正确的是________(填序号).
a.起始充入的CO的物质的量为2 mol
b.增大CO的浓度,CO的转化率增大
c.容器中压强恒定时,说明反应已达平衡状态
d.保持温度和密闭容器的容积不变,再充入1 mol CO和2 mol H2,再次达到平衡时,n(CH3OH)/n(CO)的值会变小.
(3)从反应开始至达到平衡,反应速率v(H2)=________.该温度下CO(g)+2H2(g)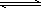 CH3OH(g)的化学平衡常数为________;若保持其他条件不变,将反应体系升温,则该反应的化学平衡常数将________(填“增大”“减小”或“不变”). CH3OH(g)的化学平衡常数为________;若保持其他条件不变,将反应体系升温,则该反应的化学平衡常数将________(填“增大”“减小”或“不变”).
(4)已知CH3OH(g)+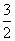 O2(g) O2(g) CO2(g)+2H2O(g) ΔH=-192.9 kJ·mol-1,H2O(l) CO2(g)+2H2O(g) ΔH=-192.9 kJ·mol-1,H2O(l) H2O(g) ΔH=+44 kJ·mol-1,请写出32 g CH3OH(g)完全燃烧生成CO2和液态水的热化学方程式:________. H2O(g) ΔH=+44 kJ·mol-1,请写出32 g CH3OH(g)完全燃烧生成CO2和液态水的热化学方程式:________.
| 
 名校课堂系列答案
名校课堂系列答案