
| A. | 25℃时,CH3COOH与CH3COONa的混合溶液,若测得混合液pH=6,则溶液中:c(CH3COO-)<c(Na+) | |
| B. | 为确定某酸H2A是强酸还是弱酸,可测NaHA溶液的pH.若pH>7,则H2A是弱酸;若pH<7,则H2A是强酸 | |
| C. | 足量锌分别和等体积、等物质的量浓度的盐酸和醋酸反应时产生H2的量相等,放出H2的速率不等 | |
| D. | 相同温度下,将足量氯化银固体分别放入相同体积的①蒸馏水、②0.1mol/L盐酸、③0.1mol/L氯化镁溶液、④0.1 mol/L硝酸银溶液中,Ag+浓度:①>④=②>③ |
分析 A.混合溶液显酸性,则c(H+)>c(OH-),结合电荷守恒分析;
B.NaHA溶液的pH<7,可能是HA-的电离程度大于水解程度;
C.醋酸为弱酸,不能完全电离;
D.氯化银难溶于水,在水中的溶解度很小,一定温度下,溶液中Ksp(AgCl)=c(Ag+)•c(Cl-)为定值,溶液中c(Cl-)越大,c(Ag+)越小.
解答 解:A.混合溶液显酸性,则c(H+)>c(OH-),溶液中电荷守恒为c(H+)+c(Na+)=c(OH-)+c(CH3COO-),则c(CH3COO-)>c(Na+),故A错误;
B.NaHA溶液的pH<7,可能是HA-的电离程度大于水解程度,所以H2A可能是弱酸,故B错误;
C.醋酸为弱酸,不能完全电离,等体积、等物质的量浓度的盐酸和醋酸反应时产生H2的量相等,但反应的速率不等,故C正确;
D.氯化银难溶于水,在水中的溶解度很小,一定温度下,溶液中Ksp(AgCl)=c(Ag+)•c(Cl-)为定值,①蒸馏水中没有氯离子、②0.1mol/L盐酸中c(Cl-)=0.1mol/L,③0.1 mol/L氯化镁溶液c(Cl-)=0.2mol/L、④0.1mol/L硝酸银溶液中c(Ag+)=0.1mol/L,溶液中c(Ag+)为④>①>②>③,故D错误.
故选:C.
点评 本题考查强弱电解质、弱电解质的电离、盐类水解、溶度积及相关计算等,难度中等,注意把握强弱电解质关键是电解质是否完全电离以及溶度积常数的应用,侧重于考查学生的分析能力和应用能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:实验题
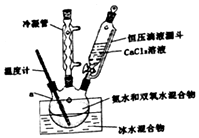 过氧化钙(CaO2)是一种白色结晶体粉末,极微溶于水,不溶于醇类、乙醚等,加热至150℃左右开始分解放出氧气,与水缓慢反应生成H2O2.易于酸反应生成H2O2
过氧化钙(CaO2)是一种白色结晶体粉末,极微溶于水,不溶于醇类、乙醚等,加热至150℃左右开始分解放出氧气,与水缓慢反应生成H2O2.易于酸反应生成H2O2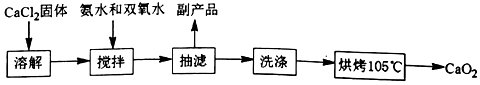
| 数据 时间 | 样品取用质量/(g) | 平均消耗体积(KMnO4)/mL |
| 放置前测定 | a | 25.00 |
| 放置一个月后测定 | a | 24.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某溶液中加入硝酸银溶液时,生成白色沉淀,说明溶液中有Cl- | |
| B. | 某溶液中加入稀硫酸溶液时,生成无色气体,说明溶液中有CO32- | |
| C. | 某溶液中加入氯化钡溶液时,生成白色沉淀,说明溶液中有SO42- | |
| D. | 某溶液中加入盐酸溶液,无明显现象,再加入氯化钡溶液时,生成白色沉淀,说明溶液中有SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 两种溶液中的c(Na+)相等 | |
| B. | 分别加热到相同温度时,CH3COONa溶液的pH大 | |
| C. | 分别加水稀释到100 mL时,两种溶液的pH依然相等 | |
| D. | 两溶液中由水电离出的c(OH-)之比为$\frac{1{0}^{-5}}{1{0}^{-9}}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
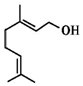
| A. | 不能使溴的四氯化碳溶液褪色 | B. | 香叶醇的分子式为C10H20O | ||
| C. | 不能使酸性高锰酸钾溶液褪色 | D. | 能发生取代反应和加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol NaHCO3晶体中含有NA个CO32- | |
| B. | 标准状况下,11.2L的18O2中所含的中子数为8NA | |
| C. | 1mol Fe与足量的稀HNO3反应,转移电子数目为3NA | |
| D. | 标准状况下,22.4L苯中含有碳氢键数目为6NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
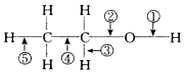
| A. | 与浓硫酸混合加热至170℃,断②⑤ | B. | 与氢卤酸反应断② | ||
| C. | 分子间脱水断①或② | D. | 与醋酸反应断② |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com