
下图中,A为气体非金属单质,D是空气中含量最多的气体,B、E、Z为无色氢化物,其中B、E为有刺激性气味的气体,C是由三种短周期非金属元素组成的离子化合物,F、I、L为白色沉淀,其中F不溶于稀硝酸,N、P是金属单质;反应②在E的浓溶液中进行,反应⑦在E的稀溶液中进行,反应②、⑦均可用于实验室制取某种气体(图中部分反应物和生成物没有列出).
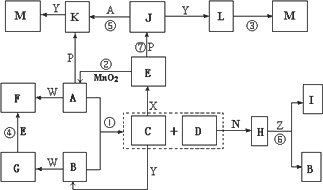
请按要求回答:
(1)写出C的电子式________,I的化学式________;
(2)反应③的化学方程式为________;
(3)反应④的离子方程式为________;
(4)由C制取E时反应物的状态是________,由J制取L时反应的环境是________.
物质结构元素周期律
 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案科目:高中化学 来源: 题型:
| A | |||||||||||||||||
| D | F | ||||||||||||||||
| G | Q | M | R | ||||||||||||||
| N | |||||||||||||||||
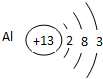
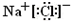
查看答案和解析>>
科目:高中化学 来源: 题型:



查看答案和解析>>
科目:高中化学 来源:2011届山东省济南市高三教学质量调研(一模)化学试卷 题型:填空题
(11分)A、B、C、D、E五种短周期元素(A、B、C、D、E分别代表元素符号),它们的原子序数依次增大;A是元素周期表中原子半径最小的元素;B元素最高价氧化物对应的水化物与其氢化物反应生成一种盐X;
D与A同主族,且与E同周期;E 元素原子的最外层电子数是其次外层电子数的=3/4倍;C与E同主族。
元素原子的最外层电子数是其次外层电子数的=3/4倍;C与E同主族。
请回答下列问题:
(1) X的化学式为______,D的原子结构示意图为______。
(2)元素的非金属性C______E(填“>”、“<”或“=”),下列各项中,能说明这一结论的事实有______(填序号)。
①氢化物H2E的酸性比H2C强
②氢化物H2C的热稳定性比H2E强
③氢化物H2E的水溶液放置在空气中会变浑浊
(3)将由BC和BC2组成的混合气体通入下图所示装置中,用来验证浓硝酸的氧化性比稀硝酸的氧化性强。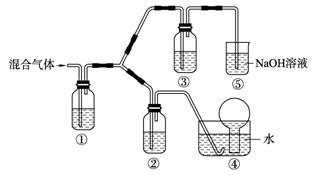
已知(ⅰ)浓硝酸能将气体BC氧化成BC2,而稀硝酸不能氧化BC。
(ⅱ) NaOH溶液与BC2反应的化学方程式为:
2NaOH+2BC2==NaBC2+NaBC+H2O
NaOH溶液与BC气体不反应
a. 装置①、②、③中盛放的药品依次是______、______、______。
b. 通入混合气体之前,应先通入一段时间某另外一种气体,试推测先通入的该气体可以是______(填一种气体的化学式)。
c. 能够说明实验已成功的现象是___________________________。
查看答案和解析>>
科目:高中化学 来源:2011届湖北省黄冈中学高三5月模拟考试(理综)化学部分 题型:填空题
在下列物质转化关系中,反应的条件和部分产物已略去。其中A为常用的溶剂,B为常见的有色气体单质。
回答下列问题:
Ⅰ.若甲、乙是两种常见金属,反应Ⅲ是工业制盐酸的 反应。
反应。
(1)反应Ⅰ中,甲在通常条件下和A剧烈反应,除丙外,还生成一种焰色反应为黄色的物质,则工业上生产甲的一般方法是 。
A.热分解法 B.热还原法 C.电解法
(2)反应Ⅱ中,乙与A在高温下反应,除丙外,还生成一种有磁性的物质,则反应Ⅱ的化学方程式是 。
(3)通过比较反应Ⅰ、Ⅱ的反应条件,可得出甲的金属性比乙的金属性 (填“强”或“弱”),比较二者金属性强弱的依据还可以是 (写出一种即可)。
(4)将2.5g甲的碳酸盐、碳酸氢盐和氢氧化物的固体混合物完全溶解于水,制成稀溶液,然后向该溶液中逐滴加入1mol·L-1的盐酸,所加入盐酸的体积与产生CO2的体积(标准状况)关系如下图所示:
①写出OA段所发生反应的离子方程式 。
②当加入35mL盐酸时,产生CO2的体积为 mL(标准状况)。
Ⅱ.若甲、乙是化合物,反应Ⅲ是工业制漂白液的反应,其中乙为非极性键的离子化合物,写出A与乙反应的化学方程式 ;
查看答案和解析>>
科目:高中化学 来源:2013-2014学年山西省四校高三第二次联考化学试卷(解析版) 题型:填空题
A、B、C、D、E、 F是周期表中短周期的六种元素,有关性质或结构信息如下表:
元素 有关性质或结构信息
A 雷雨天大气中会有A的一种单质生成
B B离子与A离子电子数相同,且是所在周期中单核离子半径最小的
C C与B同周期,且是所在周期中原子半径最大的(稀有气体除外)
D D是制造黑火药的一种成分,也可用于杀菌消毒
E E与D同周期,且在该周期中原子半径最小
F F的氢化物和最高价氧化物的水化物反应生成一种离子化合物
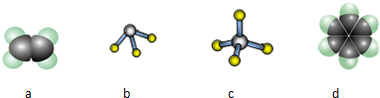
(1)A与C以原子个数比为1:1形成的化合物的电子式为 ,将0.6 mol该化合物投入到100 mL 3 mol/L BE3溶液中的离子方程式为 , 。
(2)F的氢化物是由 (极性或非极性)键形成的 (极性或非极性)分子,写出实验室制备该氢化物的化学方程式 。
(3)下图可用于实验证明D、E的非金属性的强弱。
① 溶液a和b分别为 , (写化学式)。
②溶液a与固体a反应的离子方程式为 。
③非金属性D E(填大于或小于),请从原子结构的角度解释原因 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com