

| 2.98b×10-2 |
| a |
| 2.98b |
| a |
| 2.98b |
| a |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:

| A、X中肯定存在Fe2+、NH4+、SO42- |
| B、溶液E和气体F不能发生化学反应 |
| C、X中肯定不存在CO32-、SO32-、C1- |
| D、沉淀I是A1(OH)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Cl2通入FeCl2溶液中 |
| B、CO2通入Ca(OH)2溶液中 |
| C、将AlCl3溶液滴入 NaOH 溶液中 |
| D、CO2通入BaCl2溶液中 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| X | 比例模型  |
| Y | 棍模型 |
| Z | 是X与水反应的产物 |
| U | 相对分子质量比Z少2 |
| W | 是食醋的有效成分 |
查看答案和解析>>
科目:高中化学 来源: 题型:
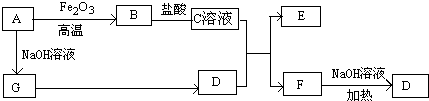
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、反应2H2O2=2H2O+O2,加入FeCl3或升高温度都能增大反应的活化分子百分数 |
| B、某原电池反应为Cu+2AgNO3=Cu(NO3)2+2Ag,装置中的盐桥中可以是装有含琼胶的KCl饱和溶液 |
| C、原电池的两极一定是由活动性不同的两种金属组成,且活泼金属一定作负极. |
| D、向2.0 mL浓度均为0.1 mol?L-1的KCl、KI混合溶液中滴加1~2滴0.01mol?L-1AgNO3溶液,振荡,生成黄色沉淀,说明Ksp(AgI)比Ksp(AgCl)大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com